Hvilken gas ligner kemisk alkalimetaller?
Her er hvorfor:
* Elektronisk konfiguration: Både alkalimetaller og brint har kun en elektron i deres yderste skal. Denne enkelt valenselektron er ansvarlig for deres lignende reaktivitet.
* tendens til at miste elektroner: Alkali -metaller mister let deres enkelt valenselektron for at danne en +1 -ion. Tilsvarende kan brint miste sin enkle elektron til at danne en proton (H+), skønt dette er mindre almindeligt end at få et elektron til dannelse af en hydridion (H-).
* reaktivitet: Både alkalimetaller og brint er meget reaktive. Alkalimetaller reagerer kraftigt med vand og reagerer let med ikke -metaller. Hydrogen reagerer også med mange elementer, især ved forhøjede temperaturer.
Det er dog vigtigt at bemærke, at:
* brint er en ikke -metal: Mens det deler nogle kemiske ligheder med alkalimetaller, klassificeres brint som et ikke -metal på grund af dets fysiske egenskaber som dens diatomiske gasformige tilstand ved stuetemperatur.
* brint er et meget mindre atom: Denne forskel i størrelse kan føre til forskellige kemiske opførsler.
Selvom brint deler nogle ligheder med alkalimetaller, betragtes det derfor ikke som et sandt medlem af gruppen.
 Varme artikler
Varme artikler
-
 NIST pH standard referencematerialer understøtter en af fremstillingens mest målte egenskaberKredit:National Institute of Standards and Technology NIST har frigivet et pH -referencemateriale i en unikt stabil form til kalibrering af de instrumenter, der bruges af en lang række producenter
NIST pH standard referencematerialer understøtter en af fremstillingens mest målte egenskaberKredit:National Institute of Standards and Technology NIST har frigivet et pH -referencemateriale i en unikt stabil form til kalibrering af de instrumenter, der bruges af en lang række producenter -
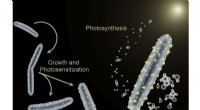 I jagten på perfekt kemi - en vision om at forene katalyseI en undersøgelse fra 2016, Berkeley Lab -forskere brugte bakterien Moorella thermoacetica i et hybrid kunstigt fotosyntesesystem til at omdanne sollys til værdifulde kemiske produkter. Kredit:Berkele
I jagten på perfekt kemi - en vision om at forene katalyseI en undersøgelse fra 2016, Berkeley Lab -forskere brugte bakterien Moorella thermoacetica i et hybrid kunstigt fotosyntesesystem til at omdanne sollys til værdifulde kemiske produkter. Kredit:Berkele -
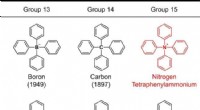 Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd
Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd -
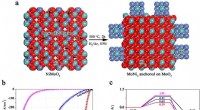 Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
- Brug af grafen til at oprette kvantebits
- Sådan tegner du en normal distribution i Excel
- Regn bringer meget midlertidig lindring til Australiens brande
- Kan en elektrisk strøm generere elektromagnetiske bølger?
- skrive en simpel ordligning, der viser, at du kan finde ud af ladningen af en ion givet dens antal…
- Hvad er Moonmoons?


