Hvad er nogle fakta om alkalimetaller?
Alkali Metaller:Fakta og funktioner
Alkalimetaller er en fascinerende gruppe af elementer! Her er nogle nøglefakta:
Generelle egenskaber:
* gruppe 1 på den periodiske tabel: Dette betyder, at de har en valenselektron, som let går tabt.
* Meget reaktiv: De reagerer kraftigt med vand, luft og mange andre stoffer.
* blød og sølvfarvet: De kan klippes med en kniv, og deres overflader pletter hurtigt i luften.
* Lav smeltnings- og kogepunkter: De er generelt bløde faste stoffer ved stuetemperatur.
* gode ledere af varme og elektricitet: Dette skyldes deres frit bevægende valenselektroner.
* Formioniske forbindelser: De mister let deres valenselektron til dannelse af +1 kationer.
Specifikke kendsgerninger:
* lithium: Det letteste metal, der bruges i batterier og psykiatriske medikamenter.
* natrium: Vigtigt for livet, findes i bordsalt og brugt i gadelamper.
* kalium: Vital for nervefunktion, der findes i bananer og andre frugter.
* rubidium: Brugt i atomur og specialiserede briller.
* cesium: De fleste reaktive alkalimetal, der bruges i atomur og som et fotoelektrisk materiale.
* francium: Radioaktiv og ekstremt sjælden, naturligt forekommende i spormængder.
Interessant trivia:
* Lithiums rolle i humørstabilisatorer: Lithiumsalte bruges til behandling af bipolar lidelse og andre mentale sundhedsmæssige forhold.
* Natriums fyrige reaktion med vand: Et lille stykke natrium, der er faldet i vandet, eksploderer og producerer brintgas og en masse varme.
* kaliums rolle i bananer: Bananer er en god kilde til kalium, hvilket er vigtigt for muskelfunktion og nervesignaler.
* Cesiums anvendelse i atomur: Cesium-ure er de mest nøjagtige tidsbekæmpelsesenheder, der er tilgængelige i GPS-systemer og andre applikationer med høj præcision.
* Franciums radioaktive karakter: Det har den korteste halveringstid for alle naturligt forekommende elementer, der hurtigt henfalder ind i andre elementer.
sikkerhed:
* Alkalimetaller er meget reaktive og bør håndteres med ekstrem omhu.
* Rør aldrig ved dem med bare hænder, da de kan forårsage alvorlige forbrændinger.
* Opbevar dem i inerte miljøer, såsom mineralolie, for at forhindre reaktioner med luft og fugt.
Alkalimetaller er unikke og fascinerende elementer med en lang række applikationer. At forstå deres egenskaber og håndtere dem sikkert er afgørende for at arbejde med dem.
Sidste artikelEr MGBR2 polær ikke -polær eller ionisk?
Næste artikelHvorfor er bly og zink forbundet?
 Varme artikler
Varme artikler
-
 Video:Hvorfor stinkende oste stinkerKredit:The American Chemical Society Nogle oste er berygtet ildelugtende, afgiver lugte, der ligner stinkende gymnastiksokker. Med hjælp fra St. James Cheese Company i New Orleans, LA, Reaktioner
Video:Hvorfor stinkende oste stinkerKredit:The American Chemical Society Nogle oste er berygtet ildelugtende, afgiver lugte, der ligner stinkende gymnastiksokker. Med hjælp fra St. James Cheese Company i New Orleans, LA, Reaktioner -
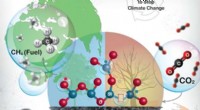 At lukke kulstofkredsløbet for at stoppe klimaforandringerneDefekter i nanosilica kan redde planeten jorden fra global opvarmning. Kredit:Ayan Maity, TIFR, Mumbai En for stor mængde kuldioxid er hovedårsagen til klimaændringer. En af de bedste metoder er a
At lukke kulstofkredsløbet for at stoppe klimaforandringerneDefekter i nanosilica kan redde planeten jorden fra global opvarmning. Kredit:Ayan Maity, TIFR, Mumbai En for stor mængde kuldioxid er hovedårsagen til klimaændringer. En af de bedste metoder er a -
 Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet
Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet -
 Styring af katalytiske reaktioner ved at ændre nanooverfladerLigesom en politimand, der kontrollerer trafikken, der består af biler af forskellige mærker og typer, nanopartikler belagt med lysreaktive katalysatorer kan styre forløbet af mange kemiske reaktioner
Styring af katalytiske reaktioner ved at ændre nanooverfladerLigesom en politimand, der kontrollerer trafikken, der består af biler af forskellige mærker og typer, nanopartikler belagt med lysreaktive katalysatorer kan styre forløbet af mange kemiske reaktioner
- Hvordan klimaændringer gjorde smeltningen af New Zealands gletsjere 10 gange mere sandsynlig
- Nano-sømme muliggør lettere og hårdere kompositmaterialer
- NASAs rumbotaniker indsamler de første data
- Ingeniører udvikler sig hurtigt, ensartet spredningsmetode for kulstofnanorør i opløsninger og fa…
- Perfekt optik gennem lysspredning
- De mærkeligste gadgets på Berlins IFA tech show


