Hvilket ru forhold kan udledes mellem temperatur og reaktionshastighed?
* Højere temperatur fører til en hurtigere reaktionshastighed.
* stigningen i hastighed er ikke lineær, men accelererer snarere, når temperaturen stiger.
Her er en sammenbrud:
* molekylær bevægelse: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperatur betyder, at molekyler bevæger sig hurtigere og kolliderer oftere.
* Kollisionsfrekvens: Hyppigere kollisioner øger chancerne for vellykkede kollisioner, som er dem, der fører til en reaktion.
* Aktiveringsenergi: Hver reaktion har en minimumsenergi, der kræves for, at molekyler skal reagere, kaldet aktiveringsenergien. Højere temperatur giver flere molekyler nok energi til at overvinde denne barriere.
Kortfattet:
* Højere temperatur =hurtigere reaktionshastighed
* Forholdet er ikke lineært, men eksponentielt.
Dette forhold er beskrevet af Arrhenius -ligningen , der kvantificerer forholdet mellem temperatur og hastighedskonstanten (som er direkte relateret til reaktionshastigheden).
 Varme artikler
Varme artikler
-
 Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab
Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab -
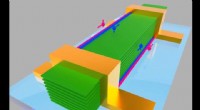 Topologi af højere orden fundet i 2-D krystalWTe2 Josephson junction:Grønne plader er lag af WTe2, orange søjler er niobium elektroder, og røde og blå linjer angiver spin op og spin ned elektroder, der bevæger sig på to hængsler af prøverne. Kre
Topologi af højere orden fundet i 2-D krystalWTe2 Josephson junction:Grønne plader er lag af WTe2, orange søjler er niobium elektroder, og røde og blå linjer angiver spin op og spin ned elektroder, der bevæger sig på to hængsler af prøverne. Kre -
 Forskere foregår i skabelsen af programmerbare kunstige væv fra syntetiske cellerFotografi af en flydende form, der indeholder et protocellulært materiale i form af en trekant med sider på 1,0 cm, der løftes fra en petriskål (til venstre). Fluorescensmikroskopibillede af det treka
Forskere foregår i skabelsen af programmerbare kunstige væv fra syntetiske cellerFotografi af en flydende form, der indeholder et protocellulært materiale i form af en trekant med sider på 1,0 cm, der løftes fra en petriskål (til venstre). Fluorescensmikroskopibillede af det treka -
 Malarias hemmelighed for at overleve i det afdækkede blodBilleder, der viser hæmkrystallisering. Det venstre billede viser normal krystallisation, og det højre viser dette i fravær af PV5 -proteinet. Kredit:Francis Crick Institute Ny forskning fra Franc
Malarias hemmelighed for at overleve i det afdækkede blodBilleder, der viser hæmkrystallisering. Det venstre billede viser normal krystallisation, og det højre viser dette i fravær af PV5 -proteinet. Kredit:Francis Crick Institute Ny forskning fra Franc
- Hvorfor familievirksomheder får mere fra kvindelige ledere
- Bakterieceller er normalt meget større end eukaryotiske celler?
- Data viser, at containerpantordninger reducerer affald på vores strande
- Forskere finder en høj intensitet af hydrofluorcarbonemissioner i Yangtze River Delta-regionen
- Hvordan bærbare computere kan forbedre læring i klasseværelser på universitetet
- Ultrastabil perovskit-solcelle forbliver stabil i mere end et år


