Hvilke typer atomer sammensætter hver type sammensætning kun metaller ikke -metal eller begge dele?
1. Metalliske forbindelser (legeringer):
* sammensætning: Disse er lavet udelukkende af metal atomer.
* Eksempler: Bronze (kobber og tin), messing (kobber og zink), stål (jern og kulstof).
2. Ikke -metalliske forbindelser:
* sammensætning: Disse er udelukkende lavet af ikke -metal atomer.
* Eksempler: Kuldioxid (CO₂), vand (H₂O), nitrogengas (N₂).
3. Ioniske forbindelser:
* sammensætning: Disse forbindelser dannes fra den elektrostatiske tiltrækning mellem metal og ikke -metal atomer. Metaller mister typisk elektroner til dannelse af positivt ladede ioner (kationer), mens ikke -metaller får elektroner til dannelse af negativt ladede ioner (ANION).
* Eksempler: Natriumchlorid (NaCl), calciumoxid (CAO), kaliumbromid (KBR).
4. Kovalente forbindelser:
* sammensætning: Disse forbindelser dannes ved deling af elektroner mellem ikke -metal atomer.
* Eksempler: Methan (CH₄), carbonmonoxid (CO), svovldioxid (SO₂).
Vigtige noter:
* polyatomiske ioner: Nogle kovalente forbindelser danner polyatomiske ioner, der fungerer som enkeltenheder i ioniske forbindelser. Eksempler inkluderer sulfation (SO₄²⁻) i calciumsulfat (Caso₄).
* Undtagelser: Der er nogle få undtagelser fra disse generelle regler. For eksempel kan nogle forbindelser, der indeholder både metaller og ikke -metaller, være kovalente, såsom metalcarbonylforbindelserne (f.eks. Nikkelcarbonyl).
Fortæl mig, hvis du gerne vil udforske specifikke eksempler mere detaljeret!
 Varme artikler
Varme artikler
-
 Syntesemetode udvider materielle mulighederSkema, der beskriver infiltrationssynteseprocessen til fremstilling af nye materialer. Top:Generering af en organisk-uorganisk hybrid ved infiltrering af uorganiske forstadier (udgangsmaterialer) til
Syntesemetode udvider materielle mulighederSkema, der beskriver infiltrationssynteseprocessen til fremstilling af nye materialer. Top:Generering af en organisk-uorganisk hybrid ved infiltrering af uorganiske forstadier (udgangsmaterialer) til -
 Nobelvindende japansk kemiker dør 85 år gammelDen japanske kemiker Ei-ichi Negishi (R, med sin familie) vandt Nobelprisen for sit arbejde med at udvikle en metode til at skabe komplekse kemikalier. Den japanske kemiker Ei-ichi Negishi, der va
Nobelvindende japansk kemiker dør 85 år gammelDen japanske kemiker Ei-ichi Negishi (R, med sin familie) vandt Nobelprisen for sit arbejde med at udvikle en metode til at skabe komplekse kemikalier. Den japanske kemiker Ei-ichi Negishi, der va -
 Video:Kemien bag farveskiftende fugleDit:The American Chemical Society Der er tusindvis af fuglearter her på Jorden, og med de tal følger stor biodiversitet. Fugle er blandt de mest farverige dyr på planeten på grund af de mange for
Video:Kemien bag farveskiftende fugleDit:The American Chemical Society Der er tusindvis af fuglearter her på Jorden, og med de tal følger stor biodiversitet. Fugle er blandt de mest farverige dyr på planeten på grund af de mange for -
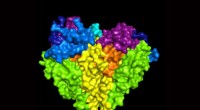 Team opdager molekylær kanal, der regulerer blodtrykketVed hjælp af et kryo-elektronmikroskop, forskere ved OHSU i Portland, Oregon, genereret en tredimensionel model af den humane epitheliale natriumkanal. Kanalen er kritisk til at kontrollere blodtrykke
Team opdager molekylær kanal, der regulerer blodtrykketVed hjælp af et kryo-elektronmikroskop, forskere ved OHSU i Portland, Oregon, genereret en tredimensionel model af den humane epitheliale natriumkanal. Kanalen er kritisk til at kontrollere blodtrykke
- Hudvaccination med mikronåleplaster, influenzafusionsprotein forbedrer effektiviteten af influenz…
- Hvad vil det sige at have 103 chlorid?
- Hvad bruges gassen i neonskilte, der producerer en lilla farve?
- Små forskelle i, hvordan en teknologi defineres, kan gøre en stor forskel i, hvordan offentlighede…
- Sådan læses en vandbarometer
- NASA finder orkanen Norman hamret af vindskæring


