Hvorfor udvides vand, når det fryser i modsætning til de fleste stoffer, så is er mindre tæt end vand?
1. Hydrogenbinding:
* Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt).
* Disse modsatte ladninger tiltrækker og danner stærke brintbindinger mellem vandmolekyler.
2. Flydende tilstand:
* I flydende vand bryder hydrogenbindingerne konstant og reformerer, hvilket gør det muligt for molekylerne at bevæge sig frit.
* Dette gør det muligt for vandmolekyler at pakke tæt sammen, hvilket resulterer i en relativt høj densitet.
3. Frysningsproces:
* Når vandet afkøles, bremser molekylerne.
* Dette gør det muligt for brintbindingerne at blive mere stabile og organiserede.
* Vandmolekyler arrangerer sig selv i en krystallinsk struktur og danner en hexagonal gitter.
4. Hexagonal gitter:
* Den hexagonale gitterstruktur af is skaber en masse tomt rum mellem vandmolekylerne.
* Denne åbne struktur er mindre tæt end den tættere pakning af flydende vandmolekyler.
Resultatet:
* Faldet i densitet får isen til at flyde. Dette er afgørende for akvatisk liv, da det forhindrer søer og oceaner i at fryse fast stof fra bunden op, hvilket giver akvatiske organismer mulighed for at overleve vinteren.
I modsætning til de fleste stoffer:
* De fleste stoffer bliver mere tætte, når de fryser, fordi molekylerne pakker tættere sammen i en fast tilstand.
* Vand er en undtagelse på grund af den unikke hydrogenbinding og den åbne struktur af dens krystallinske form.
Sidste artikelHvorfor har Gabbro en højere kemisk forvitringshastighed end granit?
Næste artikelHvad er uorganisk salt?
 Varme artikler
Varme artikler
-
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil -
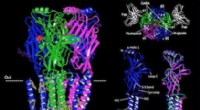 Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t -
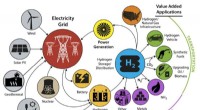 Forskere stræber efter lave omkostninger, effektive teknologier til brintproduktionKredit:US Department of Energy Mens brint ofte omtales som fremtidens forureningsfrie brændstof, især til brug i brændselscelle elektriske køretøjer, brint kan bruges til meget mere end nul-emissi
Forskere stræber efter lave omkostninger, effektive teknologier til brintproduktionKredit:US Department of Energy Mens brint ofte omtales som fremtidens forureningsfrie brændstof, især til brug i brændselscelle elektriske køretøjer, brint kan bruges til meget mere end nul-emissi -
 Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin
Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin
- Signaler fra fjerne stjerner forbinder optiske atomure over Jorden for første gang
- Salt Lakes letbanetog er luftkvalitetssøge
- Hvordan bruges magneter i legetøj?
- Amazons voksende bånd til olieindustrien irriterer nogle ansatte
- Hvilke magnetfelter kan fortælle os om liv på andre planeter
- Dobbelt eller ingenting - astronomer gentænker kvasarmiljø


