Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løst
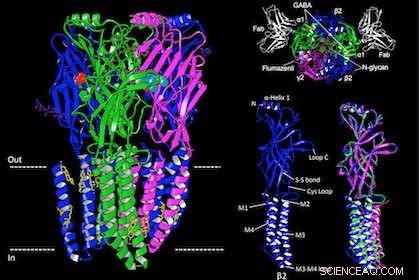
Arkitekturen af GABAA-receptoren. Kredit:UT Southwestern
UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges til at vende anæstesi og til at behandle beroligende overdoser.
"Denne undersøgelse afslører den første højopløselige strukturelle information for en af de mest udbredte og vigtige neurotransmitterreceptorer i hjernen, " sagde Dr. Ryan Hibbs, tilsvarende forfatter til undersøgelsen offentliggjort i Natur og assisterende professor i neurovidenskab og biofysik ved Peter O'Donnell Jr. Brain Institute ved UT Southwestern. "Vi er enormt begejstrede for det."
Mange stoffer - både lovlige og ulovlige - virker på GABAA-receptoren. Særligt kendte er benzodiazepinerne, som bruges til anæstesi under operation og ordineret til behandling af epilepsi, angst, og søvnløshed, han sagde, tilføjer, at løsning af strukturen af receptoren en dag kan føre til bedre behandlinger for disse tilstande.
GABAA-receptoren binder til GABA (γ-aminosmørsyre), den største hæmning, eller beroligende, neurotransmitter i den voksne hjerne. For at fungere korrekt, hjernen har brug for en balance mellem stimulerende og beroligende signaler, sagde Dr. Hibbs. Dysfunktion af GABAA-receptoren findes i tilstande præget af overdreven excitation i hjernen, såsom epilepsi. Ud over benzodiazepinklassen af beroligende midler, GABAA-receptoren er et almindeligt mål for barbiturater, bedøvelsesmidler, og alkohol, han tilføjede. Alle disse lægemidler virker på hjernen ved at øge aktiviteten af GABAA-receptoren, hvilket igen dæmper yderligere, eller beroliger, hjerneaktivitet.
"Denne receptor er en farmakologisk guldmine. hvor disse lægemidler binder, og hvordan de udøver deres virkninger, var ikke blevet forstået på det strukturelle niveau, tvinger videnskabsmænd til at basere deres forståelse af denne receptor på beregningsmodellering, " sagde Dr. Hibbs.
GABAA-receptoren har været notorisk resistent over for røntgenkrystallografi. Denne metode - længe betragtet som guldstandarden for strukturel biologi - kræver krystallisering af proteiner, så strukturer kan bestemmes baseret på røntgendiffraktionsmønstre, forklarede Dr. Hibbs, en Effie Marie Cain-stipendiat i medicinsk forskning.
Dr. Shaotong Zhu, hovedforfatteren i denne undersøgelse og en postdoc forsker i neurovidenskab, forfulgte strukturen ved krystallografi og opnåede krystaller, der diffrakterede røntgenstråler meget dårligt. Parallelt, hun arbejdede på at opnå strukturen ved hjælp af kryo-elektronmikroskopi (cryo-EM), hvilket i sidste ende lykkedes. Resultaterne giver de første 3D-atomare strukturer af receptoren bundet til dens neurotransmitter GABA og til lægemidlet flumazenil, som bruges til at vende anæstesi og til at behandle benzodiazepinoverdoser.
Forskerne opnåede højopløsningsstrukturerne ved hjælp af universitetets $22,5 millioner cryo-EM-facilitet, hvor prøver hurtigt fryses for at forhindre dannelsen af skadelige iskrystaller og derefter ses ved omkring minus 300 grader Fahrenheit (kryogene temperaturer). UT Southwesterns anlæg - som kører døgnet rundt - er et af verdens bedste faciliteter til kryo-EM strukturel biologi.

Venstre mod højre:Drs. Ryan Hibbs, Colleen Noviello, og Shaotong Zhu. Kredit:UT Southwestern
Forskerne udtænkte metoder til at udtrykke og oprense den menneskelige synaptiske GABAA-receptor fra celler i kolber og brugte elektrofysiologiske eksperimenter, i kombination med den strukturelle information fra cryo-EM, at teste virkningerne på receptoren af neurotransmitteren GABA, et benzodiazepin (diazepam), og flumazenil.
"Vi var i stand til at definere, hvordan GABA binder så selektivt til receptoren og forklare, hvorfor lægemidler som benzodiazepiner og flumazenil - midlet, der konkurrerer med disse lægemidler på samme bindingssted for at vende deres virkninger - virker specifikt på denne receptor, " Dr. Hibbs sagde. "Betydningerne er vidtrækkende for forståelsen af mekanismer for lægemiddelbinding og design af nye lægemidler til forskellige neurologiske tilstande."
 Varme artikler
Varme artikler
-
 Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af -
 Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der
Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der -
 Sådan ændres et digitalt termometer til at læse FahrenheitAflæsninger fra digitale termometre kan ofte konverteres mellem forskellige temperaturmåleenheder, såsom Celsius og Fahrenheit. Især hvis du bor i USA, kan aflæsninger i Fahrenheit være mere nyttige e
Sådan ændres et digitalt termometer til at læse FahrenheitAflæsninger fra digitale termometre kan ofte konverteres mellem forskellige temperaturmåleenheder, såsom Celsius og Fahrenheit. Især hvis du bor i USA, kan aflæsninger i Fahrenheit være mere nyttige e -
 Sådan konverteres millimoler til PPMHvis du har et specificeret volumen af opløsning med kendt molaritet, kan du hurtigt bestemme, hvor mange millimol (mmol) af det pågældende stof der findes i din prøve. Derfra kan du oversætte milli
Sådan konverteres millimoler til PPMHvis du har et specificeret volumen af opløsning med kendt molaritet, kan du hurtigt bestemme, hvor mange millimol (mmol) af det pågældende stof der findes i din prøve. Derfra kan du oversætte milli
- Kortlægning af biologiske funktioner for NUDIX -enzymer
- Forskere opdager, hvad der gør dybhavsfisketænder gennemsigtige
- Musestudie giver indsigt i, hvordan metallet akkumuleres i knoglevæv
- Forskere fremskynder metode til opdagelse af lægemidler via zombie-lignende celler
- Ny elektronisk enhed registrerer eksplosive dampe
- Egypten kan stå over for ekstrem vandknaphed inden for tiåret


