Hvorfor samles stoffer, når de afkøles?
* kinetisk energi og temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekylerne i et stof. Jo højere temperatur, jo hurtigere bevæger molekylerne sig og vibrerer.
* molekylær afstand: Ved højere temperaturer har molekyler mere kinetisk energi, hvilket får dem til at bevæge sig mere kraftigt og kollidere oftere. Dette resulterer i større gennemsnitlig afstand mellem molekyler.
* afkøling og sammentrækning: Når et stof afkøles, bremser molekylerne, deres vibrationer falder, og de kolliderer sjældnere. Denne reduktion i kinetisk energi giver molekylerne mulighed for at bevæge sig tættere sammen, hvilket resulterer i et fald i volumen - stofkontrakterne.
Undtagelser:
* Vand: Mens de fleste stoffer sammentrækker, når de afkøler, opfører vand sig usædvanligt mellem 0 ° C og 4 ° C. I dette interval udvides vand faktisk, når det afkøles. Dette skyldes den unikke hydrogenbindingsstruktur af vandmolekyler, der ændres, når temperaturen falder.
* Faseændringer: Den sammentrækning, vi normalt ser, er inden for en bestemt fase af stof (fast, flydende, gas). Når et stof skifter fase (f.eks. Flydende vand til fast is), er volumenændringer mere betydningsfulde og kan involvere ekspansion.
Kortfattet: Afkøling af et stof reducerer dens molekylers kinetiske energi, hvilket får dem til at bevæge sig tættere sammen og resultere i sammentrækning. Dette gælder for de fleste stoffer, men har nogle undtagelser som vand i et specifikt temperaturområde.
 Varme artikler
Varme artikler
-
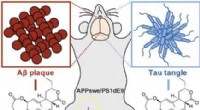 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo -
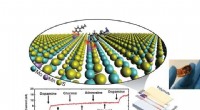 Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere -
 Ny algoritme afslører cellefabrikkers hemmelighederForskerne testede deres model ved at simulere stofskifte i mere end 300 typer gær. Sammenlignet med målt, allerede eksisterende viden, konkluderede forskerne, at modeller med forudsagte kcat-værdier n
Ny algoritme afslører cellefabrikkers hemmelighederForskerne testede deres model ved at simulere stofskifte i mere end 300 typer gær. Sammenlignet med målt, allerede eksisterende viden, konkluderede forskerne, at modeller med forudsagte kcat-værdier n -
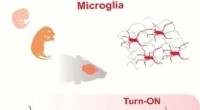 Visualisering af mikroglia i hjernevæv med et fluorescens tændt substratKredit:Angewandte Chemie International Edition En del af immunsystemet i hjernen består af såkaldte mikrogliaceller. Koreanske og singaporeanske forskere har nu udviklet en fluorescerende sonde, d
Visualisering af mikroglia i hjernevæv med et fluorescens tændt substratKredit:Angewandte Chemie International Edition En del af immunsystemet i hjernen består af såkaldte mikrogliaceller. Koreanske og singaporeanske forskere har nu udviklet en fluorescerende sonde, d
- Dataforskere og seismologer bruger dyb tremor til at forudsige kraftige jordskælv
- Hvad er forskellene i væsketryk, skaber flydende kraft på et objekt?
- Forskere, der fokuserer på klimaspørgsmål, hævder 3 Balzan-priser
- "What Is Industrial Smog?
- Papershow er bærbar whiteboard, præsentation, mere
- 'Nanojuice' kunne forbedre, hvordan læger undersøger tarmen


