Leder elektricitet i fast tilstand metal eller ikke -metal?
* Metallisk binding: Metaller har en unik type binding, hvor deres ydre elektroner holdes løst og kan bevæge sig frit gennem strukturen. Disse "delokaliserede" elektroner fungerer som et hav af ladningsbærere, så elektricitet let kan flyde.
* ikke -metaller: Ikke -metaller har på den anden side tæt bundet elektroner. De har ikke frie elektroner til at bære en elektrisk strøm, hvilket gør dem til dårlige ledere i deres solide tilstand.
Undtagelser:
* grafit: Selvom det betragtes som en ikke -metal, er grafit en undtagelse. Det har en lagdelt struktur, hvor elektroner kan bevæge sig frit inden for hvert lag, hvilket gør det til en god leder af elektricitet.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvorfor gør rock salt is koldere?
Næste artikelHvilken reaktion er 2C2H6 7O2G 4CO2 6H2O?
 Varme artikler
Varme artikler
-
 Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset
Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset -
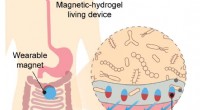 Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe
Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe -
 Normalt en isolator, diamant bliver en metallisk leder, når den udsættes for store belastninger i …Scannende elektronmikroskopbillede af en diamant nanonål udsat for reversibel elastisk bøjningsdeformation. Kredit:Amit Banerjee (Kyoto University, Kyoto, Japan), Yang Lu (City University of Hong Kong
Normalt en isolator, diamant bliver en metallisk leder, når den udsættes for store belastninger i …Scannende elektronmikroskopbillede af en diamant nanonål udsat for reversibel elastisk bøjningsdeformation. Kredit:Amit Banerjee (Kyoto University, Kyoto, Japan), Yang Lu (City University of Hong Kong -
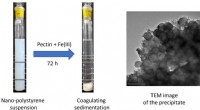 Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti
Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti
- Ny katalysator producerer effektivt brint fra havvand
- Ørkenland Jordan sigter mod grønt med 10 millioner træer
- Ny kemisk modifikation af en naturlig forbindelse til kræftbehandling
- Hvorfor er der så mange vulkaner i Auckland?
- Multimessenger-links til NASAs Fermi-mission viser, hvordan held begunstiger de forberedte
- DNS-over-HTTPS:hvorfor nettets seneste privatlivsteknologi forårsager et ramaskrig


