Hvorfor gør rock salt is koldere?
* frysningspunktdepression: Når du tilsætter salt til is, opløses saltet i det tynde vandlag, der dannes på isoverfladen. Dette opløste salt forstyrrer dannelsen af iskrystaller, hvilket gør det sværere for vandet at fryse.
* endotermisk reaktion: Processen med saltopløsning i vand er endotermisk, hvilket betyder, at den absorberer varme fra omgivelserne. Denne optagelse af varme bidrager yderligere til at sænke blandingens temperatur.
I det væsentlige gør klippesalt ikke isen selv koldere, det får det omgivende vand til at smelte ved en lavere temperatur. Derfor bruges det til at smelte is på veje og fortov:Salt sænker vandets frysepunkt, så isen kan smelte, selv når temperaturen er under 32 ° C (0 ° C).
Vigtig note: Mens salt kan få is til at smelte ved lavere temperaturer, afkøler det faktisk ikke isen yderligere. Selve istemperaturen forbliver ved 32 ° F (0 ° C), indtil den smelter helt.
Sidste artikelHvad sker der med Berkelium, når de er overophedet?
Næste artikelLeder elektricitet i fast tilstand metal eller ikke -metal?
 Varme artikler
Varme artikler
-
 Gødning gør drikkevand? En usandsynlig løsning på en global kriseYi Zheng, lektor i maskin- og industriteknik ved Northeastern, har et prøveafsaltningsfilter lavet af kogødning og et lavet af gedehamsereder i sit laboratorium i Mugar Life Sciences Building. Kredit:
Gødning gør drikkevand? En usandsynlig løsning på en global kriseYi Zheng, lektor i maskin- og industriteknik ved Northeastern, har et prøveafsaltningsfilter lavet af kogødning og et lavet af gedehamsereder i sit laboratorium i Mugar Life Sciences Building. Kredit: -
 Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig
Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig -
 Vinpolyfenoler kan afværge bakterier, der forårsager huller og tandkødssygdommeKredit:CC0 Public Domain At nippe til vin er godt for dit tyktarm og hjerte, muligvis på grund af drikkevarens rigelige og strukturelt forskellige polyfenoler. Nu rapporterer forskere i ACS Tidss
Vinpolyfenoler kan afværge bakterier, der forårsager huller og tandkødssygdommeKredit:CC0 Public Domain At nippe til vin er godt for dit tyktarm og hjerte, muligvis på grund af drikkevarens rigelige og strukturelt forskellige polyfenoler. Nu rapporterer forskere i ACS Tidss -
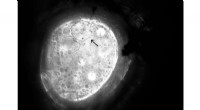 Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma
Natures frostvæske giver en formel for mere holdbar betonDette billede viser, hvordan iskrystaller, der binder til polymermolekylerne, oplever dynamisk isformning, skifte fra en kugle til en afrundet sekskant, som forskerne kalder citronis. Kredit:Living Ma
- Forskere i Hong Kong baner nye veje inden for nanoteknologi
- Følelsesmæssig reaktion på bydesign kunne styre byplanlægningen
- Er Lemonade et sammensat molekyleelement eller opløsning?
- Udgravet 400 år gammelt dokument viser, hvordan peruvianske indfødte brugte tal
- Nyopdagede hurtige radioudbrud udfordrer, hvad astronomer ved om disse magtfulde astronomiske fænom…
- Kan kønsdiversitet i bestyrelser forbedre virksomhedernes sociale engagement og bæredygtighed?


