Hvorfor tages kogetemperaturen, som når boblende bare ophører?
Her er grunden til, at vi tager kogepunktet, som når boblende bare ophører:
* ligevægt: Når bobling ophører, betyder det, at fordampningshastigheden er lig med kondensationshastigheden. Dette indikerer, at der er nået en ligevægtstilstand.
* Konstant temperatur: Ved denne ligevægt forbliver temperaturen konstant, selvom der stadig tilsættes varme. Denne konstante temperatur er kogepunktet.
* Trykafhængighed: Kogepunktet er ikke en fast værdi, men snarere afhængig af det omgivende tryk. Når trykket øges, øges kogepunktet også. Derfor specificerer vi kogepunktet ved et bestemt tryk, typisk ved standard atmosfærisk tryk (1 ATM).
Hvorfor ikke når bobling starter?
* nucleation: Kogende starter, når dampbobler dannes inden i væsken. Dette kræver energi for at overvinde væskens overfladespænding.
* overophedning: Væsken kan undertiden opvarmes over dens kogepunkt, før bobler dannes. Dette kaldes overophedning. Det er en metastabil tilstand, og tilstedeværelsen af nukleationssteder (som urenheder) eller agitation kan udløse kogning.
* ikke konstant temperatur: I de indledende stadier af kogning er væskens temperatur ikke konstant, da den stadig øges.
I resuméet Kogepunktet defineres som den temperatur, hvorpå væsken er i ligevægt med dens damp. Dette observeres bedst, når boblende ophører, hvilket indikerer, at fordampningshastigheden svarer til kondensationshastigheden, og temperaturen forbliver konstant.
 Varme artikler
Varme artikler
-
 Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv
Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv -
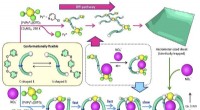 Kemikere kortlægger en kunstig molekylær selvsamlingsvej med livets kompleksitetKredit:Kommunikationskemi To veje divergerede i en kemisk syntese, og et molekyle tog dem begge. Kemikere ved University of Tokyo har undersøgt, hvordan molekylære byggesten enten kan danne et sfæ
Kemikere kortlægger en kunstig molekylær selvsamlingsvej med livets kompleksitetKredit:Kommunikationskemi To veje divergerede i en kemisk syntese, og et molekyle tog dem begge. Kemikere ved University of Tokyo har undersøgt, hvordan molekylære byggesten enten kan danne et sfæ -
 Undersøgelse giver ny indsigt i N95'ernes COVID-19 filtereffektivitetParans Paranthaman, en forsker i Chemical Chemical Division ved ORNL, koordineret forskningsindsats for at studere filtereffektiviteten af N95 -materialet. Hans offentliggjorte resultater repræsente
Undersøgelse giver ny indsigt i N95'ernes COVID-19 filtereffektivitetParans Paranthaman, en forsker i Chemical Chemical Division ved ORNL, koordineret forskningsindsats for at studere filtereffektiviteten af N95 -materialet. Hans offentliggjorte resultater repræsente -
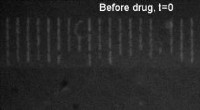 Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
- 30 Træalderen kan forudsiges fra cambiumaktiviteten ved dannelse af?
- Hvad er medfødt og læret Dyre adfærd?
- Tweeter du dit betalingskort? Ny konto har til formål at skamme dig
- Hvad skal du holde øje med på biludstillingen i Frankfurt
- Hvorfor husker vi smerter?
- Hvor mange øre ville du få for 2 nikkel?


