Hvad gør regioner af et vandmolekyle mere positivt end negativt?
1. Oxygenatomets "grådighed":
* Elektronegativitet: Oxygen er et meget elektronegativt atom, hvilket betyder, at det har en stærk attraktion for elektroner. Dette betyder, at det "trækker" elektroner i en kovalent binding mod sig selv stærkere end brint gør.
* ulig deling: I et vandmolekyle (H₂O) tiltrækker iltatomet de delte elektroner i de kovalente bindinger med hydrogenatomerne. Dette resulterer i, at iltatomet har en lidt negativ ladning (Δ-) og hydrogenatomerne med lidt positive ladninger (Δ+).
2. Den bøjede form:
* Vands geometri: Vandmolekylet har en bøjet form på grund af de to ensomme par elektroner på iltatomet. Disse ensomme par afviser hydrogenatomerne, skubber dem tættere sammen og skaber en bøjet konfiguration.
* Polaritet: Denne bøjede form betyder, at de positive ladninger af hydrogenatomerne koncentreres på den ene side af molekylet, mens den negative ladning af iltatomet koncentreres på den modsatte side.
3. Resultatet:Et polært molekyle:
* dipoler: Den ulige deling af elektroner og den bøjede form skaber en permanent adskillelse af ladning inden for vandmolekylet. Dette kaldes et dipolmoment.
* tiltrækning og interaktion: Disse dipoler tillader vandmolekyler at danne stærke brintbindinger med hinanden og andre polære molekyler. Denne stærke attraktion er ansvarlig for Water's unikke egenskaber, såsom dets høje kogepunkt og evne til at opløse mange stoffer.
Kortfattet:
Kombinationen af ilts elektronegativitet, den ulige deling af elektroner og den bøjede form af vandmolekylet skaber et permanent dipolmoment, hvilket fører til forskellige positive og negative regioner inden for molekylet.
Sidste artikelHvorfor er kemi vigtig for vores liv?
Næste artikelHvordan påvirker ændringer i temperatur og energi kemiske ændringer?
 Varme artikler
Varme artikler
-
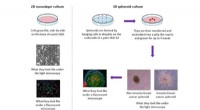 Ny indsigt i, hvordan stamceller interagerer med brystkræftceller2-D in vitro model vs 3-D in vitro model. Kredit:Dr. Morris. En Loughborough University Ph.D. studerende har givet ny indsigt i, hvordan brystkræftceller interagerer med celler i vores krop ved hj
Ny indsigt i, hvordan stamceller interagerer med brystkræftceller2-D in vitro model vs 3-D in vitro model. Kredit:Dr. Morris. En Loughborough University Ph.D. studerende har givet ny indsigt i, hvordan brystkræftceller interagerer med celler i vores krop ved hj -
 En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem
En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem -
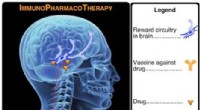 Forskere finder en måde at bekæmpe farmakoterrorismeProcessen med lægemiddelvaccination. Kredit:Scripps Research Institute Ved hjælp af en ny molekylær analyseteknik, forskere ved The Scripps Research Institute (TSRI) har identificeret den kemiske
Forskere finder en måde at bekæmpe farmakoterrorismeProcessen med lægemiddelvaccination. Kredit:Scripps Research Institute Ved hjælp af en ny molekylær analyseteknik, forskere ved The Scripps Research Institute (TSRI) har identificeret den kemiske -
 Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider
Afvisende forskning:Søværnet udvikler skibsbelægninger for at reducere brændstof, energiomkostni…Mathew Boban, en kandidatstuderende forskningsassistent ved University of Michigan, hælder hexadecanolie på et objektglas dækket med en omnifobisk belægning. De oliebaserede, meget viskøs olie glider
- Sådan bruges en Solar Power Calculator
- Magnetisme eller ingen magnetisme? Substraters indflydelse på elektroniske interaktioner
- Sådan laver du glødpulver fra husholdningsartikler
- Selv en anholdelse kan forsinke en millennials indtræden i boligejerskab, viser undersøgelse
- Dalian kohærent lyskilde afslører iltproduktion fra tre-legeme fotodissociation af vand
- Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodid


