Hvordan påvirker ændringer i temperatur og energi kemiske ændringer?
1. Temperatur:
* Forøget temperatur:
* Øget kinetisk energi: Højere temperaturer fører til, at molekyler bevæger sig hurtigere og har mere kinetisk energi. Denne øgede bevægelse resulterer i hyppigere og energiske kollisioner mellem molekyler.
* øget kollisionsfrekvens: Den højere kinetiske energi fører til hyppigere kollisioner, hvilket øger sandsynligheden for vellykkede kollisioner, der bryder obligationer og danner nye.
* overvinde aktiveringsenergi: Kemiske reaktioner kræver en vis mængde energi til at starte, kendt som aktiveringsenergien. Forøgelse af temperaturen giver flere molekyler tilstrækkelig energi til at overvinde denne barriere og reagere.
* reaktionshastighed: Som et resultat af disse faktorer fortsætter reaktionerne generelt hurtigere ved højere temperaturer.
* Nedsat temperatur:
* Nedsat kinetisk energi: Lavere temperaturer resulterer i langsommere molekylær bevægelse og færre kollisioner.
* reduceret kollisionsfrekvens: Mindre hyppige kollisioner betyder færre muligheder for obligationer til at bryde og formes.
* lavere sandsynlighed for at overvinde aktiveringsenergi: Færre molekyler har nok energi til at overvinde aktiveringsenergien ved lavere temperaturer.
* langsommere reaktionshastighed: Reaktioner bremser typisk ved lavere temperaturer.
2. Energi:
* Energiindgang:
* eksotermiske reaktioner: Disse reaktioner frigiver energi i omgivelserne, ofte som varme. Forøgelse af energiindgang kan fremskynde disse reaktioner, men er muligvis ikke nødvendige, da de genererer deres egen varme.
* endotermiske reaktioner: Disse reaktioner absorberer energi fra omgivelserne. Tilvejebringelse af energiindgang (f.eks. Varme) er vigtig for, at disse reaktioner kan forekomme.
* Energiproduktion:
* eksotermiske reaktioner: Den frigivne energi kan drive yderligere reaktioner, skabe en kædereaktion eller påvirke ligevægten af en reaktion.
* endotermiske reaktioner: Den absorberede energi kan bruges til at bryde bindinger, indlede kemiske reaktioner eller drive andre processer.
Eksempler:
* Madlavning: Varme bruges til at fremskynde de kemiske reaktioner, der er involveret i madlavning af mad, nedbryde komplekse molekyler og ændre deres strukturer og smag.
* forbrænding: Brændende brændstoffer som træ eller gas er en eksoterm reaktion, der frigiver en stor mængde energi, drevet af den genererede varme.
* Fotosyntese: Planter bruger sollysenergi til at omdanne kuldioxid og vand til glukose, en endotermisk reaktion.
Nøglepunkter:
* Aktiveringsenergi: Et grundlæggende koncept inden for kemisk kinetik, det repræsenterer den minimale energi, der kræves for at en reaktion kan forekomme.
* Rate konstant: Et mål for, hvor hurtigt en reaktion fortsætter, påvirket af temperatur og andre faktorer.
* ligevægt: I reversible reaktioner kan temperatur- og energiindgang påvirke de relative mængder reaktanter og produkter i ligevægt.
Ved at forstå, hvordan temperatur og energi påvirker kemiske ændringer, kan vi kontrollere og manipulere reaktioner til forskellige anvendelser inden for videnskab, teknologi og hverdag.
 Varme artikler
Varme artikler
-
 Akemikere udnytter solen til at genbruge plastikaffaldKredit:Pixabay/CC0 Public Domain Kemikere ved Cornell University har opdaget en måde at bruge lys og ilt til at opgradere polystyren - en type plastik, der findes i mange almindelige genstande - ti
Akemikere udnytter solen til at genbruge plastikaffaldKredit:Pixabay/CC0 Public Domain Kemikere ved Cornell University har opdaget en måde at bruge lys og ilt til at opgradere polystyren - en type plastik, der findes i mange almindelige genstande - ti -
 Væsen funktion:Vridende revner giver superhelte sejhed til dyrMantis-rejen erobrer sit bytte med et dactyl club vedhæng, som er opbygget af et kompositmateriale, der bliver sejere, efterhånden som revner vrider sig. Kredit:Purdue University billede/Pablo Zavatti
Væsen funktion:Vridende revner giver superhelte sejhed til dyrMantis-rejen erobrer sit bytte med et dactyl club vedhæng, som er opbygget af et kompositmateriale, der bliver sejere, efterhånden som revner vrider sig. Kredit:Purdue University billede/Pablo Zavatti -
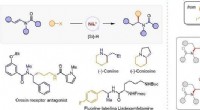 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National -
 Et nyt spin på livets oprindelse?Kredit:CC0 Public Domain Et forskerhold ved University of Tokyo har reproducerbart syntetiseret trappe-lignende supramolekyler af en enkelt hånd, eller chiralitet, ved brug af standard laboratorie
Et nyt spin på livets oprindelse?Kredit:CC0 Public Domain Et forskerhold ved University of Tokyo har reproducerbart syntetiseret trappe-lignende supramolekyler af en enkelt hånd, eller chiralitet, ved brug af standard laboratorie
- Hvad vi ved om, hvordan 'for evigt kemikalier' påvirker sundheden
- Hvilke faktorer i naturlige regioner?
- Et nyt kromkompleks udsender lys i uhåndgribelig NIR-II-bølgelængde
- Er SMB'er klar til Ciscos schweiziske hærkniv for tilslutning?
- Din mad kan være med til at gøre mere klæbrig, sikrere lim til bærbare computere, emballage, mø…
- Yderst til højre:picknmix-ideologier og direkte beskeder online giver en dødbringende ny kombinati…


