Hvad er solubilty af N2 i vand 25C og 1,0 atm ved hjælp af konstant KH til H20 ved 6,4 x 10-4 moll. Pengeautomat?
Forstå Henrys lov
Henrys lov siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på denne gas over væsken. Matematisk:
* c =k h * P
Hvor:
* C er koncentrationen af den opløste gas (mol/l)
* k h er Henrys lov konstant (mol/l · atm)
* p er det delvise tryk på gassen (ATM)
Beregning
1. Identificer de givne værdier:
* K h =6,4 x 10⁻⁴ mol/l · atm
* P =1,0 atm (delvis tryk på N₂)
2. Anvend Henrys lovligning:
* C =(6,4 x 10⁻⁴ mol/l · atm) * (1,0 atm)
3. Løs for C:
* C =6,4 x 10⁻⁴ mol/l
Derfor er opløseligheden af N₂ i vand ved 25 ° C og 1,0 atm 6,4 x 10⁻⁴ mol/l.
 Varme artikler
Varme artikler
-
 Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span
Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span -
 Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro
Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro -
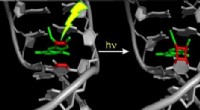 Belysning af reaktionsmekanismen ved PUVA-lysterapi til hudsygdommeReaktionsstadier, når et psoralenmolekyle binder til DNA. Resultatet er, at psoralen er permanent bundet til DNAet via en cyclobutanring. Cellen er ændret og dermed beskadiget, og udløser processen me
Belysning af reaktionsmekanismen ved PUVA-lysterapi til hudsygdommeReaktionsstadier, når et psoralenmolekyle binder til DNA. Resultatet er, at psoralen er permanent bundet til DNAet via en cyclobutanring. Cellen er ændret og dermed beskadiget, og udløser processen me -
 Forskere skaber første bærbare teknologi til påvisning af cyanotoksiner i vandNorth Carolina State University forskere har udviklet den første bærbare teknologi, der kan teste for cyanotoksiner i vand. For at teste for cyanotoksiner, brugere placerer en dråbe vand på en tilpass
Forskere skaber første bærbare teknologi til påvisning af cyanotoksiner i vandNorth Carolina State University forskere har udviklet den første bærbare teknologi, der kan teste for cyanotoksiner i vand. For at teste for cyanotoksiner, brugere placerer en dråbe vand på en tilpass
- Hvilket udfører det meste af det endokrine system?
- Hvorfor ændres antallet af protoner ikke for et enkelt element, mens neutroner og elektroner kan?
- Hvorfor forvandler planter sollys CO2 og vand til sukker ilt?
- Former for mekanisk vejrning
- Sprogets udvikling? Der er en app til det
- Fish Farming Basics


