Når kulstof brændes i nærvær af ilt, kombineres for at producere dioxid, hvis du starter med 6 gram og 11 de reagerer fuldstændigt, hvor mange dioxid?
1. Skriv den afbalancerede kemiske ligning:
C + O₂ → CO₂
Denne ligning fortæller os, at et atom af carbon (C) reagerer med et molekyle af ilt (O₂) for at producere et molekyle af kuldioxid (CO₂).
2. Konverter gram til mol:
* carbon: 6 gram kulstof / 12,01 g / mol (molmasse kulstof) =0,5 mol kulstof
* ilt: 11 gram ilt / 32 g / mol (molmasse ilt) =0,34 mol ilt
3. Bestem den begrænsende reaktant:
* Den afbalancerede ligning viser et forhold på 1:1 mol mellem kulstof og ilt.
* Da vi har mindre ilt (0,34 mol) end kulstof (0,5 mol), er ilt den begrænsende reaktant. Dette betyder, at ilt vil blive konsumeret fuldstændigt, og mængden af produceret kuldioxid bestemmes af mængden af tilgængeligt ilt.
4. Beregn mol af kuldioxid:
* Molforholdet mellem ilt og kuldioxid er 1:1.
* Da vi har 0,34 mol ilt, producerer vi 0,34 mol kuldioxid.
5. Konverter mol af kuldioxid til gram:
* 0,34 mol CO₂ * 44,01 g/mol (molmasse kuldioxid) = 15,0 gram co₂
Derfor, hvis du starter med 6 gram kulstof og 11 gram ilt, og de reagerer fuldstændigt, vil du producere 15,0 gram kuldioxid.
Sidste artikelKan du give mig en akrostiker for Igneous?
Næste artikelHvor mange forskellige stoffer kan laves med fire elementer?
 Varme artikler
Varme artikler
-
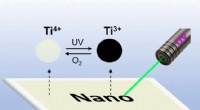 Skriv med lys på titaniumdioxid:Overskrivbare UV-følsomme overflader lavet af dopede TiO2 nanokrys…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202203700 Det er lykkedes for forskere at fremstille et belægningsmateriale, der kan skrives på ved hjælp a
Skriv med lys på titaniumdioxid:Overskrivbare UV-følsomme overflader lavet af dopede TiO2 nanokrys…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202203700 Det er lykkedes for forskere at fremstille et belægningsmateriale, der kan skrives på ved hjælp a -
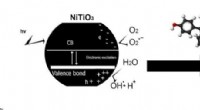 Kemikere omdanner titanium nanopartikler til et effektivt våben mod forureningDen nye metode Kredit:Yahya Absalan Forskere fra RUDN University (Rusland) har fundet frem til en ny metode til at omdanne titanium nanopartikler til et effektivt stof, der er i stand til at fjern
Kemikere omdanner titanium nanopartikler til et effektivt våben mod forureningDen nye metode Kredit:Yahya Absalan Forskere fra RUDN University (Rusland) har fundet frem til en ny metode til at omdanne titanium nanopartikler til et effektivt stof, der er i stand til at fjern -
 I betragtning af virkningen af den indendørs kemi -cocktailKredit:CC0 Public Domain Et par forskere, et med det kinesiske videnskabsakademi i Kina, den anden med University of Toronto i Canada har genbesøgt emnet indendørs kemi og dens indvirkning på menn
I betragtning af virkningen af den indendørs kemi -cocktailKredit:CC0 Public Domain Et par forskere, et med det kinesiske videnskabsakademi i Kina, den anden med University of Toronto i Canada har genbesøgt emnet indendørs kemi og dens indvirkning på menn -
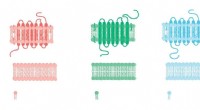 Formskiftende receptorer kan forklare mystiske lægemiddelfejlKredit:CC0 Public Domain For at sukker smager sødt og for at kaffe er stimulerende, eller endda for lys at blive set, først skal de alle lande på en G-proteinkoblet receptor. Allestedsnærværende o
Formskiftende receptorer kan forklare mystiske lægemiddelfejlKredit:CC0 Public Domain For at sukker smager sødt og for at kaffe er stimulerende, eller endda for lys at blive set, først skal de alle lande på en G-proteinkoblet receptor. Allestedsnærværende o
- Forskere skaber fladt magisk vindue med flydende krystaller
- Simulerer sprøjt på mikroskopisk niveau
- Er nitrogen et metal ikke -metal eller metalloid?
- En undersøgelse viser den uventede effekt af sorte huller ud over deres egne galakser
- Sådan laver du en robotarm
- Hvordan man forbedrer fraktionel destillation


