Hvordan er det muligt, at det ydre elektron fra et overgangselement går til indre skal?
* Elektronkonfiguration: Overgangselementer har deres yderste elektroner i d-orbitaler, og disse D-orbitaler er faktisk * indre * til den yderste S-orbital.
* Energiniveau: Mens S-Orbitaler generelt er højere i energi, er D-Orbitaler meget tæt på energi. Denne lille energiforskel giver D-ELECTRONS mulighed for at deltage i binding sammen med S-ELECTRONS.
* binding: Når overgangselementer danner bindinger, er D-elektronerne ofte involveret sammen med S-elektronerne. Dette er grunden til, at overgangsmetaller udviser variable oxidationstilstande og danner en lang række farverige forbindelser.
Eksempel: Lad os tage jern (Fe) som et eksempel:
* jordtilstand: Den elektroniske konfiguration af Fe er [AR] 3d⁶ 4S².
* ionisering: Når FE danner en ion (som fe²⁺ eller fe³⁺), mister den elektroner. Disse elektroner kommer primært fra 4S -orbitalen, men 3D -elektronerne kan også være involveret.
Kortfattet: Overgangselementer har ikke elektroner bogstaveligt talt * flytter * til indre skaller. D-elektronerne er allerede placeret i en indre skal, og deres energi nærhed til de yderste S-elektroner giver dem mulighed for at deltage i binding. Dette gør overgangselementer unikke i deres kemiske egenskaber og giver dem deres karakteristiske egenskaber.
Sidste artikelEr bordsalt en væske under overfladen?
Næste artikelHvad er den ædle gaskonfiguration for lanthanum?
 Varme artikler
Varme artikler
-
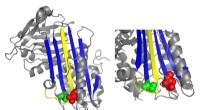 Hvad en sjælden blodsygdom kan lære os om blodpropperEt bånddiagram af antithrombin fremhæver placeringer af funktionelt vigtige mutationer. Kredit:Irene Martinez-Martinez Når en person kommer til skade, blodpropper er afgørende. Imidlertid, når far
Hvad en sjælden blodsygdom kan lære os om blodpropperEt bånddiagram af antithrombin fremhæver placeringer af funktionelt vigtige mutationer. Kredit:Irene Martinez-Martinez Når en person kommer til skade, blodpropper er afgørende. Imidlertid, når far -
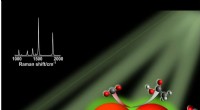 Lyshøstende nanopartikelkatalysatorer viser løfte i jagten på vedvarende kulstofbaserede brændst…Under de rette forhold, sølv nanopartikler, repræsenteret ved de store orange kugler, kan absorbere synligt lys. Ladningsbærere produceret ved lysexcitation overføres til CO2 og vand, tillader omdanne
Lyshøstende nanopartikelkatalysatorer viser løfte i jagten på vedvarende kulstofbaserede brændst…Under de rette forhold, sølv nanopartikler, repræsenteret ved de store orange kugler, kan absorbere synligt lys. Ladningsbærere produceret ved lysexcitation overføres til CO2 og vand, tillader omdanne -
 Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s
Enheden kunne høre sygdom gennem strukturer, der huser cellerEn enhed bruger lydbølger til at detektere stivheden af en ekstracellulær matrix, et strukturelt netværk, der indeholder celler. Ændringer i stivheden af denne struktur kan indikere spredning af s -
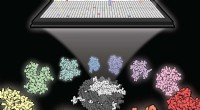 Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing
Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing
- Hvilke bevægelseslove forklarede forslag elliptiske kredsløb?
- Hvorfor hænger to magneter sammen?
- Hvordan vil du beskrive Niagara Falls?
- Toplab CERN lancerer en ny nøgleaccelerator
- Hvordan flagermus overlever norske vinternætter
- Konvertering til LED-belysning bringer ny form for lysforurening til Europa


