Hvilket af følgende påvirker hastighedskonstant en reaktion?
1. Temperatur: Forøgelse af temperaturen øger generelt hastighedskonstanten. Dette skyldes, at højere temperaturer fører til flere kollisioner mellem molekyler, og en større andel af disse kollisioner har nok energi til at overvinde aktiveringsenergibarrieren.
2. Aktiveringsenergi (EA): Jo lavere aktiveringsenergi, jo hurtigere fortsætter reaktionen, og jo højere er hastighedskonstanten. Dette skyldes, at en lavere aktiveringsenergi betyder, at færre molekyler skal være på et højt energiniveau for at reagere.
3. Katalysator: En katalysator giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket øger hastighedskonstanten. Katalysatorer påvirker ikke reaktionens ligevægtsposition, men de fremskynder den hastighed, hvormed ligevægt er nået.
4. Reaktantkoncentration: Mens koncentrationen af reaktanter påvirker * -hastigheden * af en reaktion, påvirker den * ikke * hastighedskonstanten. Hastighedskonstanten er en konstant værdi for en given reaktion ved en bestemt temperatur.
5. Overfladeareal (for heterogene reaktioner): For reaktioner, der forekommer på en overflade, kan øget overfladeareal af reaktanten øge reaktionshastigheden. Dette skyldes, at flere molekyler kan komme i kontakt med overfladen og reagere.
6. Tryk (til gasfase-reaktioner): Forøgelse af trykket fra en gasfase-reaktion kan øge reaktionshastigheden, hvilket kan påvirke hastighedskonstanten.
7. Tilstedeværelse af lys (til fotokemiske reaktioner): Visse reaktioner initieres af lys, og lysets intensitet kan påvirke hastighedskonstanten.
Nøglepunkt: Hastighedskonstanten er en grundlæggende egenskab ved en bestemt reaktion under specifikke betingelser. Mens faktorer som temperatur, aktiveringsenergi og katalysatorer kan ændre hastighedskonstanten, ændrer de ikke reaktionens samlede karakter.
 Varme artikler
Varme artikler
-
 Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri
Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri -
 Forskere opfinder små, genlukkelige pakker til levering af materialer i køDenne simulering viser lagene i pakkerne - et sort ydre lag, en rød, udskifteligt lag, der forbinder de to, og det glasagtige inderlag i guld. Blå vandmolekyler omgiver pakken. Kredit:Lucas Antony
Forskere opfinder små, genlukkelige pakker til levering af materialer i køDenne simulering viser lagene i pakkerne - et sort ydre lag, en rød, udskifteligt lag, der forbinder de to, og det glasagtige inderlag i guld. Blå vandmolekyler omgiver pakken. Kredit:Lucas Antony -
 Celleadfærd, engang indhyllet i mystik, afsløres i nyt lysGavin King og et team af forskere ved University of Missouri er et skridt tættere på at forstå celleadfærd ved hjælp af et specialiseret mikroskop. Kredit:University of Missouri-Columbia En celles
Celleadfærd, engang indhyllet i mystik, afsløres i nyt lysGavin King og et team af forskere ved University of Missouri er et skridt tættere på at forstå celleadfærd ved hjælp af et specialiseret mikroskop. Kredit:University of Missouri-Columbia En celles -
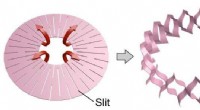 Elektronik integreret i musklen via Kirigami2D -doughnutform (venstre:før deformation) og 3D -cylindrisk form (højre:efter deformation). Kredit:Toyohashi University of Technology. Et forskerhold i afdelingen for elektrisk og elektronisk inf
Elektronik integreret i musklen via Kirigami2D -doughnutform (venstre:før deformation) og 3D -cylindrisk form (højre:efter deformation). Kredit:Toyohashi University of Technology. Et forskerhold i afdelingen for elektrisk og elektronisk inf
- Hvor bruges ultralyds- og infralydsbølger?
- Sådan fungerer F/A-22 Raptors
- Hvorfor ubeskyttet blik på formørkelsen vil få dig til at se stjerner
- Undersøgelse afslører omfanget af teknologi-faciliteret misbrug i Australien
- Sort hul kollision kan være eksploderet med lys
- Hvad er et system lavet af 25 satellitter?


