Opløsning af et solidt i vand normalt en endotermisk ændring?
* endotermisk opløsning: Dette betyder, at processen absorberer varme fra omgivelserne, hvilket får løsningen til at føle sig koldere. Dette sker, når den energi, der kræves for at bryde bindingerne mellem faste molekyler, er større end den frigivne energi, når de faste molekyler interagerer med vandmolekyler. Eksempler inkluderer:
* Opløsning af ammoniumnitrat (brugt i kolde pakker)
* Opløsning af kaliumchlorid
* eksoterm opløsning: Dette betyder, at processen frigiver varme i omgivelserne, hvilket får løsningen til at føle sig varmere. Dette sker, når den energi, der frigives af interaktionen mellem de faste molekyler og vandmolekyler, er større end den energi, der er nødvendig for at bryde bindingerne inden for det faste stof. Eksempler inkluderer:
* Opløsning af natriumhydroxid
* Opløsning af svovlsyre
Kortfattet: Enthalpy -ændringen (varmeændring) under opløsning bestemmes af den balance mellem den energi, der er nødvendig for at bryde bindingerne i det faste stof og energien, der frigøres, når det faste interagerer med vand.
 Varme artikler
Varme artikler
-
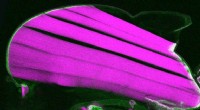 Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et -
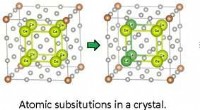 Udnyttelse af symmetrier:Fremskynder beregningsstudiet af solide løsningerGrafisk abstrakt. Kredit:Journal of Chemical Information and Modeling (2022). DOI:10.1021/acs.jcim.2c00389 Symmetri er et udbredt træk i naturen på alle skalaer. For eksempel kan vores blotte øjne
Udnyttelse af symmetrier:Fremskynder beregningsstudiet af solide løsningerGrafisk abstrakt. Kredit:Journal of Chemical Information and Modeling (2022). DOI:10.1021/acs.jcim.2c00389 Symmetri er et udbredt træk i naturen på alle skalaer. For eksempel kan vores blotte øjne -
 Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At
Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At -
 Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
- Fryseramme:Forskere løser, hvordan celler folder proteiner ud
- Hvad betyder forstyrrelse mellem nord og syd?
- Undersøgelse evaluerer emissioner fra kinesiske indre farvande over de seneste 30 år
- Cellen udfører sine normale funktioner under.?
- Undersøgelse afslører, at kælede køer, der arbejder som terapidyr, udviser en stærk præference…
- Fremstilling af nanostrukturer med silke kunne gøre rene rum grønne rum


