Fryseramme:Forskere løser, hvordan celler folder proteiner ud
Kredit:CC0 Public Domain
En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringlelignende masse til genbrug. Cdc48 spiller en afgørende rolle i at optrevle de brugte proteiner.
"Cdc48 er cellens schweiziske hærkniv og kan interagere med så mange forskellige substrater, sagde Peter Shen, Ph.D., assisterende professor i biokemi ved University of Utah Health og seniorforfatter på papiret. "Indtil nu havde vi ikke en forståelse af præcis, hvordan det fungerer."
Shen førte et multi-institutionelt team af forskere til at identificere nøglestrukturer af Cdc48 for at visualisere dets bølger, når det udfolder proteiner. Resultaterne er tilgængelige online i 27. juni-udgaven af Videnskab .
"Vi satte os for at gøre dette, fordi vi bekymrer os om, hvordan molekylære maskiner fungerer, " sagde Shen. "Vi besluttede at skærpe ind på Cdc48 på grund af klinisk relevans."
Årevis, forskere har vidst, at en enkeltpunktsmutation i Cdc48 kan kaskade ind i alvorlige sygdomme, herunder amyotrofisk lateral sklerose (ALS) og Charcot-Marie-Tooth sygdom type 2Y.
"Human Cdc48 er forbundet med flere sygdomme og er målet for indsatsen for at udvikle terapeutiske midler til behandling af kræftformer, " sagde Christopher Hill, DPhil., fremtrædende professor i biokemi ved U of U Health og medkorresponderende forfatter på undersøgelsen. "Den struktur, som vi har bestemt, kan bruges til at fremme indsatsen for at udvikle mere effektive inhibitorer og terapeutiske midler."
I undersøgelsen, forskerholdet rensede Cdc48 direkte fra gærceller (Saccharomyces cerevisiae) og tog snapshots af de oprensede partikler i forskellige konfigurationer, efter at det var blevet flashfrosset ved hjælp af kryogen elektronmikroskopi (cryo-EM).
"Cellerne gør allerede det hårde arbejde for os ved at lave disse komplekser, " sagde Shen. "Fordi denne metode er så hurtig, vi har fanget Cdc48 i færd med at udfolde et proteinsubstrat."
Ved at bruge denne tilgang, forskerholdet demonstrerede, hvordan Cdc48 folder proteinet ud ved at føre det gennem en central pore i komplekset, ved hjælp af en hånd-over-hånd transportør-lignende bevægelse. Det genbrugte virvar, de afbildede, var et mysterium, indtil samarbejdspartnere ved Brigham Young University anvendte massespektrometri-proteomik på det samme høstede kompleks for at afsløre det anonyme proteinan-inaktive proteinphosphatase 1-kompleks.
Shen mener, at disse resultater gælder for menneskelige celler, fordi Cdc48 er meget konserveret.
"Vi tror, at den struktur, vi har løst her, vil ligne det, vores kroppe udtrykker lige nu, " han sagde.
Forskerholdet var ikke i stand til at visualisere hele komplekset, fordi Cdc48 interagerer med flere bindingspartnere næsten samtidigt. Denne effektive multitasking slører rekonstruktionen; imidlertid, Shen ønsker at fortsætte med at udforske, hvordan Cdc48 formår at binde sig til så mange partnere på nogenlunde samme tid.
"Den fedeste del er, at dette [arbejde] viser, at vi kan tage et protein direkte ud af værtsceller og afbilde dem i deres oprindelige tilstand, " sagde Shen. "Jeg tror, det er fremtiden for kryo-EM-feltet."
 Varme artikler
Varme artikler
-
 Denne brintbrændstofmaskine kunne være den ultimative guide til selvforbedringGuosong Zeng, en postdoc i Berkeley Labs Chemical Sciences Division, på arbejde ved at teste et kunstigt fotosynteseapparat lavet af galliumnitrid. Zeng, sammen med Berkeley Labs personaleforsker Fran
Denne brintbrændstofmaskine kunne være den ultimative guide til selvforbedringGuosong Zeng, en postdoc i Berkeley Labs Chemical Sciences Division, på arbejde ved at teste et kunstigt fotosynteseapparat lavet af galliumnitrid. Zeng, sammen med Berkeley Labs personaleforsker Fran -
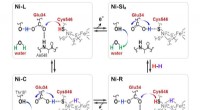 Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk
Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk -
 Metalion-gennembrud fører til nye biomaterialerMetaller som jern og calcium spiller en afgørende rolle i den menneskelige krop, så det er ingen overraskelse, at bioingeniører gerne vil integrere dem i det bløde, strækbare materialer, der bruges ti
Metalion-gennembrud fører til nye biomaterialerMetaller som jern og calcium spiller en afgørende rolle i den menneskelige krop, så det er ingen overraskelse, at bioingeniører gerne vil integrere dem i det bløde, strækbare materialer, der bruges ti -
 Neutroner kigger ind i en kørende motorForskere brugte neutroner til at sondere en kørende motor ved ORNLs Spallation Neutron Source, giver dem mulighed for at teste en aluminium-cerium-legering under driftsforhold. Fra venstre, forskere O
Neutroner kigger ind i en kørende motorForskere brugte neutroner til at sondere en kørende motor ved ORNLs Spallation Neutron Source, giver dem mulighed for at teste en aluminium-cerium-legering under driftsforhold. Fra venstre, forskere O
- Hurtigt voksende dele af Afrika oplever en overraskelse:mindre luftforurening fra sæsonbestemte bra…
- Supercomputere driver forskning i iontransport
- Kostændring nødvendig for at redde store områder af troperne, undersøgelse advarer
- Syntese af et kulstof nanobånd med potentielle anvendelser inden for nanoteknologi
- Europa ser ud til at genskabe internettet med nye regler om ophavsret
- Har Salt Affect Photosynthesis?


