Mikroorganismer bygger de bedste brændstofeffektive brintceller
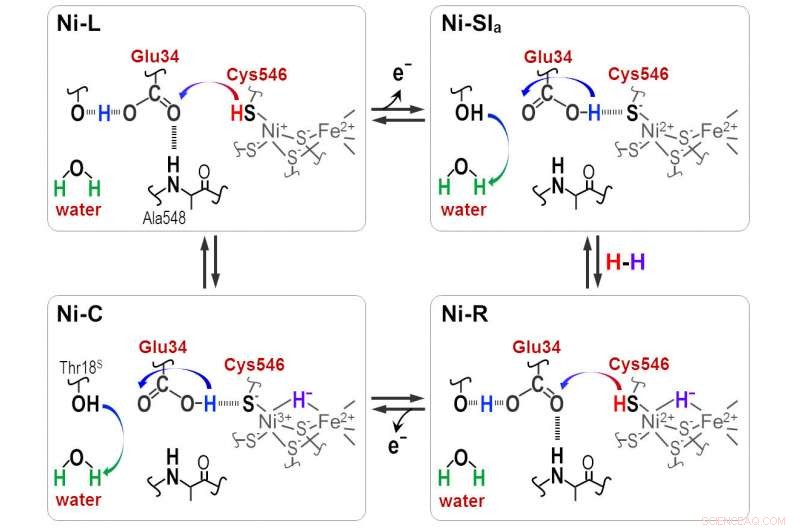
Protoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota
For alle de fremskridt, teknologien har gjort gennem vores liv, i mange tilfælde står den bag, hvad naturen kan. Myrer kan bære 5000 gange deres vægt, og edderkoppespind er fem gange stærkere end stål. Brændstofeffektiviteten er ikke anderledes. I en ny stud in Angewandte Chemie International Edition , forskere fra Nara Institute of Science and Technology (NAIST) rapporterer nye detaljer om protonoverførselsvejen for nikkel-jern [NiFe]-hydrogenase ved hjælp af Fourier transform infrarød spektroskopi (FTIR). Denne overførsel er afgørende for brintmetabolismen af mikroorganismer, og undersøgelsen giver forskerne en bedre forståelse af, hvordan man efterligner naturen i konstruktionen af nye biobrændselsceller.
Brintmetabolisme er en af de ældste former for energiproduktion for livet og en af de mest intensivt studerede på grund af dens betydning for evolution. Det har også tiltrukket sig opmærksomhed, da det er en ren energikilde. Blandt de enzymer, der er ansvarlige for hydrogenmetabolisme, [NiFe]-hydrogenase er den mest udbredte og ældste.
Man ved meget om enzymet. Det oxiderer reversibelt hydrogenatomer gennem sit Ni-Fe-aktive sted, som er omgivet af specifikke aminosyrer. Imidlertid, bemærker NAIST professor Shun Hirota, hvem ledede undersøgelsen, visse grundlæggende elementer i de kemiske reaktioner skal forstås, før du bruger denne nanomaskine til at designe biobrændstofteknologier.
"Hydrid og proton koordinerer med Ni-Fe-stedet i protonations-deprotonationscyklussen, resulterer i fire hydrogenase -tilstande. Men protonoverførselsvejen er stadig ukendt, " han siger.
En årsag til den manglende klarhed har været en manglende evne til at løse strækfrekvenser af forskellige hydrogenbindinger. I det nye værk, Hirotas team, i samarbejde med andre forskere i Japan og Kina, løste dette problem ved at observere fotokonversioner af tre hydrogenase -tilstande med FTIR -spektre.
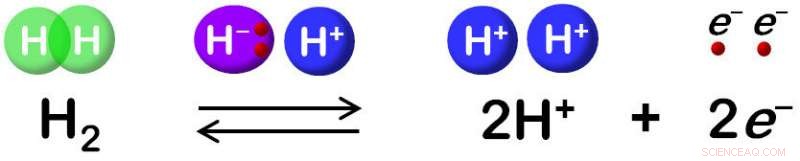
Hydrogenase katalyserer reversibel oxidation af H2. Kredit:Shun Hirota
Distinkte absorbansfrekvenser afslørede, at en af de fire cysteiner, cystein 546, sammen med en anden aminosyre, glutaminsyre 34, og et bestilt vandmolekyle er afgørende for overførslen. Forskerne brugte den nye information til at udlede, hvordan svovlmolekylet af cystein 546 og syregruppen i glutaminsyre 34 danner hydrogenbindinger for at regulere hydrogentransporten.
"Vores resultater viser, at cystein 546 er en protondonor og acceptor i [Ni-Fe]-hydrogenasecyklussen. De viser også, hvordan en lavbarriere-hydrogenbinding for glutaminsyre 34 dannes og spaltes under den katalytiske cyklus, " bemærker Hirota.
Mikroorganismer har tilpasset sig en bredere vifte af miljøforhold end mennesker. De kan findes i det behagelige klima i vores soveværelser til de mest fjendtlige miljøer på jorden. Dermed, at se, hvordan [Ni-Fe]-stedet for [Ni-Fe]-hydrogenase overfører protoner optimalt, giver et paradigme for forskere, der søger at fremstille højeffektive energikatalysatorer under en lang række forhold.
"Livet har brugt milliarder af år på at tilpasse sig energi. Vi tror på, at det giver os den bedste model for energieffektivitet i fremtiden, " siger Hirota.
 Varme artikler
Varme artikler
-
 Fremskridt hen imod tilslutning af en antibiotikapumpeSusan Rempe står foran Center for Integrated Nanotechnologies, hvor noget af hendes forskning om bakteriepumper blev lavet. Hendes team fra Sandia National Laboratories og University of Illinois i Urb
Fremskridt hen imod tilslutning af en antibiotikapumpeSusan Rempe står foran Center for Integrated Nanotechnologies, hvor noget af hendes forskning om bakteriepumper blev lavet. Hendes team fra Sandia National Laboratories og University of Illinois i Urb -
 Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap
Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap -
 Eksperimenter med fordampning og overfladeAlle væsker fordampes, hvis de udsættes for visse elementer. Den hastighed, hvormed en væske fordamper, afhænger af dens molekylstruktur. De andre faktorer, der påvirker fordampning, er overfladear
Eksperimenter med fordampning og overfladeAlle væsker fordampes, hvis de udsættes for visse elementer. Den hastighed, hvormed en væske fordamper, afhænger af dens molekylstruktur. De andre faktorer, der påvirker fordampning, er overfladear -
 Parfumemagere søger naturligt, bæredygtige dufteKredit:CC0 Public Domain I 1921, parfumeur Ernest Beaux opdagede, at tilføjelse af syntetiske aldehyder til naturlige rose- og jasmindufte producerede den helt rigtige duftkombination til den ikon
Parfumemagere søger naturligt, bæredygtige dufteKredit:CC0 Public Domain I 1921, parfumeur Ernest Beaux opdagede, at tilføjelse af syntetiske aldehyder til naturlige rose- og jasmindufte producerede den helt rigtige duftkombination til den ikon
- Hvordan luftteknologi hjalp os med at opdage den største piktiske bosættelse i Skotland
- Forskere bevæger sig tættere på praktisk fotonisk kvanteberegning
- Farverig, magnetiske Janus-bolde kunne hjælpe med at forhindre falskmøntnere
- Boeing støtter statens skatteændring for at undgå EU-sanktioner
- Atomisk tynde nanotråde omdanner varme til elektricitet mere effektivt
- Forskere udvikler en ny metode til at reducere kvantestøj


