Hvorfor danner gruppe 2 -metaller ioner med gebyrer?
Her er en sammenbrud:
* Elektronkonfiguration: Gruppe 2-metaller har to elektroner i deres yderste energiniveau (S-orbital).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal (Octet -regel).
* ionisering: For at opnå en stabil octet mister gruppe 2 -metaller let deres to yderste elektroner og danner kationer (positivt ladede ioner) med en +2 ladning.
Eksempel:
* magnesium (mg) Har en elektronkonfiguration af 2, 8, 2. den mister sine to ydre elektroner til at danne en mg²⁺ion med en stabil konfiguration, der ligner neon (2, 8).
Kortfattet:
+2 -ladningen på gruppe 2 metalioner opstår fra deres tendens til at miste to elektroner for at opnå en stabil octet -elektronkonfiguration. Denne tendens er drevet af den elektrostatiske tiltrækning mellem den positivt ladede kerne og de negativt ladede elektroner, hvilket gør det energisk gunstigt for disse metaller at miste elektroner og blive positivt ladede ioner.
 Varme artikler
Varme artikler
-
 Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc
Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc -
 Et nyt paradigme for materialeidentifikation baseret på grafteoriDen forenklede graf og den faktiske krystalstruktur (øverst til højre) af spinel Co3O4. Kredit:Science China Press Materials Genome Initiative (MGI) og National Materials Genome Project er blevet
Et nyt paradigme for materialeidentifikation baseret på grafteoriDen forenklede graf og den faktiske krystalstruktur (øverst til højre) af spinel Co3O4. Kredit:Science China Press Materials Genome Initiative (MGI) og National Materials Genome Project er blevet -
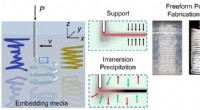 Unik metode til at fremstille friformede strukturer af termoplast i mikropartikelformige gelerEn polymerblæk udskrives af en DIW 3D-printer i Bingham-plastikmikropartikelgeler som indlejringsmedie. De omgivende indlejringsmedier understøttede de trykte blæk og forårsagede in situ faseadskillel
Unik metode til at fremstille friformede strukturer af termoplast i mikropartikelformige gelerEn polymerblæk udskrives af en DIW 3D-printer i Bingham-plastikmikropartikelgeler som indlejringsmedie. De omgivende indlejringsmedier understøttede de trykte blæk og forårsagede in situ faseadskillel -
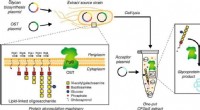 Bioingeniører skaber vej til personlig medicinSkematisk af enkelt-pot CFGpS-teknologi. Glycoengineered E. coli, der er modificeret med (i) genomiske mutationer, der gavner glykosyleringsreaktioner og (ii) plasmid -DNA til fremstilling af essentie
Bioingeniører skaber vej til personlig medicinSkematisk af enkelt-pot CFGpS-teknologi. Glycoengineered E. coli, der er modificeret med (i) genomiske mutationer, der gavner glykosyleringsreaktioner og (ii) plasmid -DNA til fremstilling af essentie
- Hvorfor kuldioxid har så stor indflydelse på jordens klima
- Hvor mange peroxisomer er til stede pr. Celle?
- Hvad er en god måde at sepperatopløsning af såsom salt fra opløsninger?
- Brændselscelle røntgenundersøgelse beskriver virkningerne af temperatur og fugt på ydeevnen
- Speciel algoritme til Twitter kan afsløre flypassagerernes tilfredshed
- Forskere bruger røntgenvideo af perlehøns, der går gennem valmuefrø til at skabe en 3D-model, hv…


