Hvad er antallet af ikke -bindende elektronpar på det centrale atom NH2CL?
1. Tegn Lewis -strukturen:
* nitrogen (n) er det centrale atom, fordi det er det mindst elektronegative.
* brint (H) og klor (Cl) er de omkringliggende atomer.
* nitrogen har 5 valenselektroner.
* Hydrogen Har 1 valenselektron hver.
* klor Har 7 valenselektroner.
Lewis -strukturen ser sådan ud:
H
|
N - Cl
|
H
2. Grev valenselektroner:
* Nitrogen:5
* Brint (2 atomer):2
* Klor:7
* I alt:14 valenselektroner
3. Distribuer elektroner:
* Hver enkelt binding (N-H og N-CL) bruger 2 elektroner.
* Der er 3 bindinger ved hjælp af 6 elektroner.
* Resterende elektroner:14 - 6 =8 elektroner.
* Placer de resterende 8 elektroner omkring det centrale nitrogenatom som ensomme par (4 elektronpar).
4. Bestem ikke -bondende par:
* Nitrogenatomet har to ensomme par elektroner (4 elektroner).
Derfor er antallet af ikke -bindende elektronpar på det centrale atom (nitrogen) i NH2CL 2.
 Varme artikler
Varme artikler
-
 Svagt bundet salt er en nøgleingrediens til højrenhed Li@C60 filmForskere fra University of Tsukuba dyrkede med succes en Li@C60-film på en kobberoverflade for at studere de molekylære orbitaler. Kredit:University of Tsukuba Udover at gøre det til et af de mest
Svagt bundet salt er en nøgleingrediens til højrenhed Li@C60 filmForskere fra University of Tsukuba dyrkede med succes en Li@C60-film på en kobberoverflade for at studere de molekylære orbitaler. Kredit:University of Tsukuba Udover at gøre det til et af de mest -
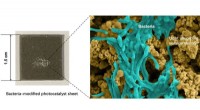 Ny teknologi omdanner sollys, vand og kuldioxid til acetat og oxygen til højværdibrændstoffer og …Fotokatalysatorark indeholdende lysabsorberende partikler og bakterier. Kredit:Northumbria University Forskere har skabt en ny teknologi, der kan hjælpe med at tackle klimaændringer og adressere de
Ny teknologi omdanner sollys, vand og kuldioxid til acetat og oxygen til højværdibrændstoffer og …Fotokatalysatorark indeholdende lysabsorberende partikler og bakterier. Kredit:Northumbria University Forskere har skabt en ny teknologi, der kan hjælpe med at tackle klimaændringer og adressere de -
 At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af
At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af -
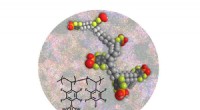 Banebrydende materiale gør vej til brintbrug til brændselsceller under varme, tørre forholdForskere har udviklet en protonleder til brændselsceller baseret på polystyrenphosphonsyrer, der opretholder høj protonisk ledningsevne ved høje temperaturer uden vand. Kredit:Los Alamos National Labo
Banebrydende materiale gør vej til brintbrug til brændselsceller under varme, tørre forholdForskere har udviklet en protonleder til brændselsceller baseret på polystyrenphosphonsyrer, der opretholder høj protonisk ledningsevne ved høje temperaturer uden vand. Kredit:Los Alamos National Labo
- Undersøgelse af magnetisk excitationsinduceret spinstrøm i chromtrihalogenider
- Fremtidens arbejde vil ramme udsatte mennesker hårdest
- Undersøgelse af virkningerne af valutakursudsving på teknologiske læringsrater
- Udarbejde en menneskelig niche
- Hvilken rækkefølge blev følgende energikilder opdaget af mennesker fossile brændstofceller Bioma…
- Hvad er svaret også 46200000 divideret med 12000 i videnskabelig notation?


