Hvad har en større masse 2-atomer af bly eller 5,1 x 10-23 mol helium?
1. Forståelse af mol og atommasse
* mol: En mol er en måleenhed, der repræsenterer et specifikt antal partikler (atomer, molekyler osv.). En mol indeholder 6,022 x 10^23 partikler (Avogadro's nummer).
* atommasse: Atommassen af et element er den gennemsnitlige masse af dets atomer, udtrykt i atommasseenheder (AMU). Du kan finde atommasse på den periodiske tabel.
2. Beregning af masse
* bly (PB): Atommassen af bly er cirka 207,2 amu. Da vi har 2 atomer bly, ville den samlede masse være:
2 Atomer PB * 207.2 AMU/ATOM PB =414.4 AMU
* helium (He): Atommassen af helium er cirka 4,00 amu. For at finde massen på 5,1 x 10^-23 mol helium bruger vi følgende trin:
* Beregn antallet af heliumatomer:
5,1 x 10^-23 mol han * (6,022 x 10^23 atomer han/mol he) =3,07 atomer han
* Beregn den samlede masse:
3.07 atomer han * 4,00 amu/atom He =12,28 amu
3. Sammenligning
* 2 Atomer af bly har en masse på 414,4 amu.
* 5,1 x 10^-23 mol helium har en masse på 12,28 amu.
Derfor har 2 atomer af bly en større masse end 5,1 x 10^-23 mol helium.
Sidste artikelHvilken kemisk egenskab er fælles for elementerne i gruppe 18 på periodisk tabel?
Næste artikelEr et nikkelrent stof?
 Varme artikler
Varme artikler
-
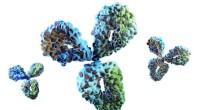 I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini
I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini -
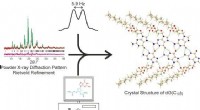 Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi -
 Video:Er det virkelig kun renset?Kredit:The American Chemical Society Det kan være svært at kende, hvad man må og ikke må, når man vasker sit tøj. men kemien har fået din ryg. Med en hurtig lektion i tekstilkemi, du vil være i s
Video:Er det virkelig kun renset?Kredit:The American Chemical Society Det kan være svært at kende, hvad man må og ikke må, når man vasker sit tøj. men kemien har fået din ryg. Med en hurtig lektion i tekstilkemi, du vil være i s -
 Ny måde at forvandle nummer syv plastik til værdifulde produkterWSU-forskerholdet, inklusive postdoc-forsker Yu-Chung Chang, brugte PLA-plastaffald til at skabe en højkvalitets harpiks til 3D-print. Kredit:WSU En metode til at konvertere en almindeligt smidt pl
Ny måde at forvandle nummer syv plastik til værdifulde produkterWSU-forskerholdet, inklusive postdoc-forsker Yu-Chung Chang, brugte PLA-plastaffald til at skabe en højkvalitets harpiks til 3D-print. Kredit:WSU En metode til at konvertere en almindeligt smidt pl
- Hvilken kraft får en snebold, der ruller ned ad den græsklædte bakke, til at bremse eller acceler…
- Hvad laver en hærkampingeniør?
- Travle ældre stjerner overgår stjernernes unge, viser ny undersøgelse
- Ny kvantemodtager den første til at registrere hele radiofrekvensspektret
- Miljøretfærdighed forsvarer ofre for vold og mord
- Data mining syndromer


