Hvorfor er berylliumoxid amfoterisk karakter?
1. Lille størrelse og høj opladningstæthed af beryllium:
- Beryllium er et meget lille atom med en høj positiv ladningstæthed.
- Dette fører til en stærk polariserende kraft, hvilket betyder, at det kan fordreje elektronskyen af andre atomer, hvilket gør det mere sandsynligt at danne både sure og basale forbindelser.
2. BEO's kovalent karakter:
- Bindingen i BEO har en betydelig kovalent karakter på grund af den lille størrelse af både beryllium og ilt.
- Denne kovalente karakter tillader BEO at fungere som både en syre og en base.
3. Evne til at reagere med både syrer og baser:
- med syrer: BEO reagerer med syrer for at danne salte og vand og fungerer som base. For eksempel:
`` `
BEO + 2HCI → BECL2 + H2O
`` `
- med baser: BEO reagerer med stærke baser som NaOH for at danne beryllater og fungerer som en syre. For eksempel:
`` `
BEO + 2NAOH → NA2BEO2 + H2O
`` `
4. Dannelse af både berylliumsalte og beryllater:
- BEO's evne til at reagere med både syrer og baser fører til dannelsen af både berylliumsalte (som BECL2) og beryllater (som Na2BeO2), hvilket yderligere demonstrerer dens amfoteriske karakter.
Sammenfattende gør kombinationen af Berylliums lille størrelse, høj ladningstæthed, kovalent karakter af BEO og dens evne til at reagere med både syrer og baser det til et amfoterisk oxid.
 Varme artikler
Varme artikler
-
 Pulserne stiger, da ny undersøgelse afslører plantens hemmeligheder, der holder folk i roBeroligende indflydelse -- Indisk Snakeroot. Kredit:John Innes Center Kemiske hemmeligheder for en plante, der er blevet brugt gennem historien for dens beroligende virkning, er blevet afsløret i
Pulserne stiger, da ny undersøgelse afslører plantens hemmeligheder, der holder folk i roBeroligende indflydelse -- Indisk Snakeroot. Kredit:John Innes Center Kemiske hemmeligheder for en plante, der er blevet brugt gennem historien for dens beroligende virkning, er blevet afsløret i -
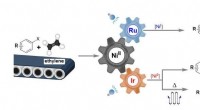 Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere
Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere -
 En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M
En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M -
 Dette røde lys betyder, at gå efter medicinske opdagelserUVA’s Hui-wang Ai, Ph.d., og Shen Zhang, Ph.d., har udviklet en enkel og effektiv forbedring af fluorescerende biosensorer, der er meget udbredt inden for videnskabelig og medicinsk forskning. Kredit:
Dette røde lys betyder, at gå efter medicinske opdagelserUVA’s Hui-wang Ai, Ph.d., og Shen Zhang, Ph.d., har udviklet en enkel og effektiv forbedring af fluorescerende biosensorer, der er meget udbredt inden for videnskabelig og medicinsk forskning. Kredit:
- Hvordan måler astronomer afstande, som lys bevæger sig?
- Forvandling af pollen til 3D-printblæk til biomedicinske applikationer
- Hvordan spredes menneskelige kropsassocierede mikrober? Mikrobiomers transmissionslandskab
- Forskningshøjdepunkter skal sikre droner og robotbiler mod cyberangreb
- Dating app Tinder at flytte ud af forældres hjem
- Sådan holder du kernen ren


