Hvad er ændringen i frysepunktet for vand, når 35,5 g saccharose opløst 55,0 vand?
1. Forstå koncepterne
* frysningspunktdepression: Når et opløst stof (som saccharose) opløses i et opløsningsmiddel (som vand), er frysepunktet for opløsningen lavere end frysepunktet for det rene opløsningsmiddel. Dette er en kolligativ egenskab, hvilket betyder, at det afhænger af mængden af opløst stof, ikke dens identitet.
* frysningspunkt depression ligning: ΔT f =K f * m * i
* ΔT f =Ændring i frysepunkt (° C)
* K f =molal frysepunkt depression konstant (for vand, k f =1,86 ° C/m)
* m =molalitet af opløsningen (mol opløst stof pr. kg opløsningsmiddel)
* i =van't hoff -faktor (for saccharose, i =1, da den ikke adskiller sig i opløsning)
2. Beregn molalitet (m)
* molmasse af sucrose (C 12 H 22 O 11 ): 12 (12,01 g/mol) + 22 (1,01 g/mol) + 11 (16,00 g/mol) =342,34 g/mol
* mol af sucrose: 35,5 g / 342,34 g / mol =0,103 mol
* Masse vand i kg: 55,0 g / 1000 g / kg =0,055 kg
* molalitet: 0,103 mol / 0,055 kg =1,87 mol / kg
3. Beregn ændringen i frysepunktet (ΔT f )
* ΔT f =K f * m * i
* ΔT f =1,86 ° C/m * 1,87 mol/kg * 1
* ΔT f =3,48 ° C
Derfor sænkes frysepunktet for opløsningen med 3,48 ° C sammenlignet med det rene vand.
Sidste artikelHvor mange protoner elektroner og neutroner har uran?
Næste artikelHvorfor er berylliumoxid amfoterisk karakter?
 Varme artikler
Varme artikler
-
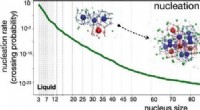 Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt -
 Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu
Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu -
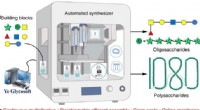 Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e
Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e -
 Nogle kan lide det kryogentGengivelse af First Element Fuels flydende brintstofpumpe til detailhandel. Pumpen indeholder en baldakin på toppen, og brændstoflageret er afbildet på bagsiden. Kredit:First Element Fuel Sandia N
Nogle kan lide det kryogentGengivelse af First Element Fuels flydende brintstofpumpe til detailhandel. Pumpen indeholder en baldakin på toppen, og brændstoflageret er afbildet på bagsiden. Kredit:First Element Fuel Sandia N
- Nobelvindende ICAN fordømmer stigningen i atomvåbeninvesteringer
- Elbiler:Sådan kommer vi dertil
- Kinas biludstilling fremhæver industriens elektriske ambitioner
- Imødegå klimaændringer med kølige fortove
- Hvordan et gen i en lille fisk kan ændre et akvatisk økosystem
- Filippinerne evakuerer næsten 1 million, da tyfonen Goni nærmer sig


