Hvordan bruges Hess -loven til at beregne enthalpi -reaktionsændringen?
Hess's lov:Et kraftfuldt værktøj til entalpi -beregninger
Hess's lov er et grundlæggende princip inden for termokemi, der siger: Enthalpyændringen af en reaktion er uafhængig af den vej, der er taget , hvilket betyder, at det er det samme, om reaktionen forekommer i et trin eller flere trin. Denne lov giver os mulighed for at beregne enthalpiændringen af en reaktion, der ikke kan måles direkte ved anvendelse af entalpiændringerne af kendte reaktioner.
Sådan bruges Hess's lov:
1. Identificer målreaktionen: Bestem den afbalancerede kemiske ligning for den reaktion, hvis entalpi -ændring du vil beregne.
2. Find kendte reaktioner: Find reaktioner med kendte entalpiændringer (normalt angivet i tabeller eller datablad), der involverer reaktanter og produkter fra målreaktionen.
3. manipulere de kendte reaktioner: Det kan være nødvendigt at:
* omvendt En kendt reaktion for at matche målreaktionens retning. Husk at vende en reaktion ændrer tegnet på dens entalpi -ændring.
* Multiplicer En kendt reaktion med en faktor, der matcher de støkiometriske koefficienter for målreaktionen. Husk at multiplicere en reaktion med en faktor multiplicerer også dens entalpi -ændring med denne faktor.
4. Kombiner de manipulerede reaktioner: Tilføj de manipulerede reaktioner sammen. Enthalpyændringen af den kombinerede reaktion vil være summen af entalpienændringerne af de individuelle reaktioner.
5. Sørg for annullering: Sørg for, at alle arter, der vises på begge sider af de kombinerede reaktioner, annullerer kun reaktanterne og produkterne fra målreaktionen.
6. Beregn entalpiændringen: Enthalpyændringen af målreaktionen er summen af entalpienændringerne af de manipulerede reaktioner.
Eksempel:
Lad os beregne entalpiændringen af følgende reaktion:
`` `
CO (G) + 1/2 O2 (G) -> CO2 (G)
`` `
Vi kender følgende reaktioner og deres entalpi ændrer sig:
`` `
C (s) + O2 (g) -> CO2 (g) ΔH =-393,5 kJ/mol
C (S) + 1/2 O2 (G) -> CO (G) ΔH =-110,5 kJ/mol
`` `
For at få målreaktionen kan vi:
* Vend den anden reaktion:
`` `
Co (g) -> c (s) + 1/2 o2 (g) ΔH =+110,5 kJ/mol
`` `
* Tilføj den omvendte anden reaktion på den første reaktion:
`` `
C (s) + O2 (g) -> CO2 (g) ΔH =-393,5 kJ/mol
Co (g) -> c (s) + 1/2 o2 (g) ΔH =+110,5 kJ/mol
-------------------------------
CO (g) + 1/2 o2 (g) -> CO2 (g) ΔH =-283 kJ/mol
`` `
Derfor er enthalpiændringen af målreaktionen -283 kJ/mol .
Nøglepunkter:
* Hess's lov er et kraftfuldt værktøj til beregning af entalpiændringer af reaktioner, der er vanskelige eller umulige at måle direkte.
* Det er afhængig af princippet om, at entalpi -ændringer er statsfunktioner, hvilket betyder, at de kun afhænger af systemets oprindelige og endelige tilstande, ikke den vej, der er taget.
* Manipulerer omhyggeligt kendte reaktioner for at matche målreaktionen og være opmærksom på tegn og koefficienter for entalpiændringer.
Ved at bruge Hess's lov kan du forudsige entalpiændringer for en lang række reaktioner ved hjælp af kendte termokemiske data.
Sidste artikelHvad er et anilinium?
Næste artikelHvorfor proces fjerner kulstof fra atmoshinten?
 Varme artikler
Varme artikler
-
 Kemisk festende bakterier fjerner sandsynligt kræftfremkaldende stof fra forurenet vandKredit:New Jersey Institute of Technology Selvom det ikke fremgår af de fleste produktingrediensetiketter, den organiske kemiske stabilisator og fremstillingsbiprodukt, 1, 4-dioxan, kan findes i u
Kemisk festende bakterier fjerner sandsynligt kræftfremkaldende stof fra forurenet vandKredit:New Jersey Institute of Technology Selvom det ikke fremgår af de fleste produktingrediensetiketter, den organiske kemiske stabilisator og fremstillingsbiprodukt, 1, 4-dioxan, kan findes i u -
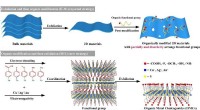 2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b
2-D-bestilte organiske metalchalcogenider udviklet med vidt indstillelige elektroniske båndgabSkematisk illustration af forskningen. Kredit:Prof. XUs gruppe To-dimensionelle (2-D) materialer, som viser fremragende fysiske og kemiske egenskaber, har modtaget hidtil uset opmærksomhed og er b -
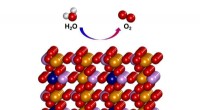 Elektrokatalysator udviser fremragende vandspaltningsaktivitetVist ovenfor demonstrerer den teoretisk forudsagte struktur af Fe 3 Co(PO 4 ) 4 @rGO. Jern (Fe) er angivet som gul, kobolt (Co) i blåt, fosforsyre (P) i lilla, oxygen (O) i rødt, og hydrogen (H)
Elektrokatalysator udviser fremragende vandspaltningsaktivitetVist ovenfor demonstrerer den teoretisk forudsagte struktur af Fe 3 Co(PO 4 ) 4 @rGO. Jern (Fe) er angivet som gul, kobolt (Co) i blåt, fosforsyre (P) i lilla, oxygen (O) i rødt, og hydrogen (H) -
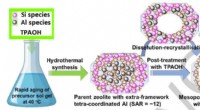 Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit
Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit
- Er kemiske reaktioner en fysisk eller egenskab?
- Hvilken ældre videnskab eller teknologi?
- Hvad betyder det, når de siger, at masse er konserveret i en blanding?
- Pop-up vådområder, der hjælper med at migrere kystfugle
- Følelser kan få kyllinger til at blive røde i ansigtet
- Frankrig udvikler anti-satellit-laservåben:minister


