Hvad er antallet af elektroner på ydre niveau til de første 18 elementer?
| Element | Symbol | Atomnummer | Valenselektroner |
| --- | --- | --- | --- |
| Brint | H | 1 | 1 |
| Helium | Han | 2 | 2 |
| Lithium | Li | 3 | 1 |
| Beryllium | Være | 4 | 2 |
| Bor | B | 5 | 3 |
| Carbon | C | 6 | 4 |
| Nitrogen | N | 7 | 5 |
| Ilt | O | 8 | 6 |
| Fluor | F | 9 | 7 |
| Neon | Ne | 10 | 8 |
| Natrium | Na | 11 | 1 |
| Magnesium | Mg | 12 | 2 |
| Aluminium | Al | 13 | 3 |
| Silicium | Si | 14 | 4 |
| Fosfor | P | 15 | 5 |
| Svovl | S | 16 | 6 |
| Klor | Cl | 17 | 7 |
| Argon | Ar | 18 | 8 |
Nøglepunkter:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom. Det er dem, der er involveret i kemisk binding.
* Periodiske tendenser: Antallet af valenselektroner øges generelt, når du bevæger dig fra venstre til højre over en periode (række) i den periodiske tabel. Antallet nulstilles til 1 i starten af hver nye periode.
* Undtagelser: Nogle elementer, især i overgangsmetaller, har mere komplicerede elektronkonfigurationer, og deres valenselektronantal følger muligvis ikke dette enkle mønster.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvad ville der ske, hvis du bryder molekyler fra hinanden?
Næste artikelHvad er positive partikler i atomet?
 Varme artikler
Varme artikler
-
 Skræddersyede materialer med ultrahurtige forbindelserNår atomisk tynde lag af to materialer stables og snoes, et heterostruktur-materiale opstår. En ny forbindelse er dannet, næsten øjeblikkeligt, med specielle energitilstande - kendt som interlayer exc
Skræddersyede materialer med ultrahurtige forbindelserNår atomisk tynde lag af to materialer stables og snoes, et heterostruktur-materiale opstår. En ny forbindelse er dannet, næsten øjeblikkeligt, med specielle energitilstande - kendt som interlayer exc -
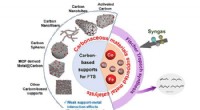 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
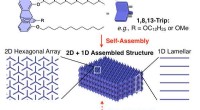 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles -
 Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
- Kan du forvandle sollys til en laserstråle?
- Hvad kan du antage om mængden af vanddamp i luft, hvis der ikke er nogen forskel mellem våd og t…
- Laboratorier solsystem arv
- Plantecellulose forhindrer kortslutninger i batterier
- Hvad er på tryk? Michigans økonomi
- Kan Twitter hjælpe med katastrofeberedskab? Ny forskning undersøger hvordan


