Er organiske forbindelser mindre opløselige i vand?
Her er en sammenbrud:
Faktorer, der påvirker opløselighed:
* Polaritet: Vand er et meget polært opløsningsmiddel. Organiske forbindelser med polære funktionelle grupper (som alkoholer, carboxylsyrer, aminer) er mere tilbøjelige til at opløses i vand, fordi de kan danne hydrogenbindinger med vandmolekyler.
* Størrelse og form: Mindre, mere kompakte organiske molekyler er mere tilbøjelige til at opløses i vand end større, mere komplekse molekyler.
* Funktionelle grupper: Tilstedeværelsen og arten af funktionelle grupper påvirker stærkt opløselighed. Polære funktionelle grupper som hydroxyl (-OH), carboxyl (-COOH) og amino (-NH2) forbedrer vandopløselighed.
* Intermolekylære kræfter: Stærke intermolekylære kræfter inden for det organiske molekyle, som van der Waals -kræfter eller hydrogenbinding, kan hindre opløselighed i vand.
Eksempler:
* ethanol (C2H5OH) er opløseligt i vand Fordi den har en polær hydroxylgruppe (-OH), der kan danne hydrogenbindinger med vandmolekyler.
* hexan (C6H14) er uopløselig i vand Fordi det er et ikke -polært carbonhydrid uden polære funktionelle grupper.
* eddikesyre (CH3COOH) er opløselig i vand på grund af sin polære carboxylgruppe (-cooh).
* benzen (C6H6) er uopløselig i vand Fordi det er et ikke -polært aromatisk carbonhydrid.
Generelt:
* ikke -polære organiske forbindelser er generelt mindre opløselige i vand.
* polære organiske forbindelser er generelt mere opløselige i vand.
Det er vigtigt at bemærke:
* opløselighed er et spektrum, ikke et binært koncept. Nogle organiske forbindelser kan være delvist opløselige i vand.
* Andre faktorer som temperatur og tryk påvirker også opløselighed.
Derfor er det unøjagtigt at sige, at alle organiske forbindelser er mindre opløselige i vand. Det er mere nøjagtigt at sige, at opløseligheden af organiske forbindelser i vand afhænger af deres kemiske struktur og tilstedeværelsen af polære funktionelle grupper.
 Varme artikler
Varme artikler
-
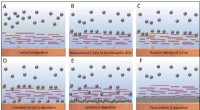 At overvinde et batteris fatale fejlSkema af litumaflejringsmekanisme i tilfælde af grafenoxid-modificerede prøver. A-F) Adsorption af Li-ioner til den lithiofile GOn-belægning og kontrolleret levering på stedet af Li-ioner til metalove
At overvinde et batteris fatale fejlSkema af litumaflejringsmekanisme i tilfælde af grafenoxid-modificerede prøver. A-F) Adsorption af Li-ioner til den lithiofile GOn-belægning og kontrolleret levering på stedet af Li-ioner til metalove -
 Hvordan afsløring af zeolitters strukturelle udvikling vil gavne fremtidige syntetiske designsKredit:Shutterstock Udvidelse af zeolit-fleksibilitetsvinduet giver materialevidenskaben mere kontrol over designet og betegnelsen af metal-organiske rammer (MOFer) for deres katalytiske egenska
Hvordan afsløring af zeolitters strukturelle udvikling vil gavne fremtidige syntetiske designsKredit:Shutterstock Udvidelse af zeolit-fleksibilitetsvinduet giver materialevidenskaben mere kontrol over designet og betegnelsen af metal-organiske rammer (MOFer) for deres katalytiske egenska -
 Er lim svaret på klimakrisen?Skorstensstak:en harpiks udviklet af et team ved Swansea University kunne hjælpe med at forbedre kulstoffangstmaterialer. Kredit:Veeterzy Er lim svaret på klimaændringer? Forskere ved Energy Safet
Er lim svaret på klimakrisen?Skorstensstak:en harpiks udviklet af et team ved Swansea University kunne hjælpe med at forbedre kulstoffangstmaterialer. Kredit:Veeterzy Er lim svaret på klimaændringer? Forskere ved Energy Safet -
 Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor
Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor
- Hvad sker der, når jernsulfat opvarmes, skriv navnet og afbalancer den kemiske ligning for forandri…
- Prævention for parasitter:Forskere afslører nyt vaccinemål for malaria
- Sådan konverteres centimeter til centimeter squared
- Røgsignaler:Hvordan brændende planter fortæller frø at stige fra asken
- Forskere skaber omvendt osmose-membraner med justerbar tykkelse
- Hvad er stabiliteten af en isotop baseret på dens 1. antal kun neutroner 2. protoner 3. forhold t…


