Når forbindelsen Na2S danner, hvad sker der med Na- og S -ioner?
* natrium (NA) mister en elektron: Natriumatomer er i gruppe 1 i den periodiske tabel, hvilket betyder, at de har en valenselektron. De har en tendens til at miste denne elektron for at opnå en stabil elektronkonfiguration som den ædle gas neon. Dette resulterer i et positivt ladet natriumion (NA⁺).
* svovl (r) får to elektroner: Svovlatomer er i gruppe 16 i den periodiske tabel, hvilket betyder, at de har seks valenselektroner. De får to elektroner for at opnå en stabil elektronkonfiguration som den ædle gas -argon. Dette resulterer i en negativt ladet sulfidion (S²⁻).
* ionisk bindingsdannelse: De modsatte ladede natriumioner (Na⁺) og sulfidioner (s²⁻) tiltrækkes af hinanden gennem elektrostatiske kræfter. Denne attraktion danner en ionisk binding, der skaber forbindelsens natriumsulfid (Na₂s).
Nøglepunkter:
* Elektrostatisk attraktion: Den stærke attraktion mellem de modsatte ladede ioner holder forbindelsen sammen.
* neutral forbindelse: Den samlede ladning af forbindelsen er neutral, fordi de positive ladninger fra de to natriumioner afbalancerer den negative ladning fra sulfidionen.
* Formelenhed: Formelenheden NA₂S repræsenterer det enkleste forhold mellem ioner i forbindelsen.
Fortæl mig, hvis du gerne vil have flere detaljer om ionisk binding!
Sidste artikelEr organiske forbindelser mindre opløselige i vand?
Næste artikelHvilket element har det atomnummer på 168?
 Varme artikler
Varme artikler
-
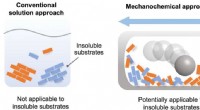 Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et
Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et -
 Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin
Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin -
 Kemisk dans af koboltkatalyse kan bane vej for solbrændstofferArgonne -kemikere Dugan Hayes, Lin Chen, og Ryan Hadt har identificeret en hurtig elektronisk proces, der kan hjælpe vandspaltningsreaktionen i koboltholdige katalysatorer. Koboltkatalysatorer er rela
Kemisk dans af koboltkatalyse kan bane vej for solbrændstofferArgonne -kemikere Dugan Hayes, Lin Chen, og Ryan Hadt har identificeret en hurtig elektronisk proces, der kan hjælpe vandspaltningsreaktionen i koboltholdige katalysatorer. Koboltkatalysatorer er rela -
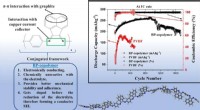 Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold
Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold
- Hvilken nedbrydningsmad for at producere energi?
- Hvad var støvdæmpningseffekten?
- Hvorfor udgør en mangel på overgangsformer problemer for den evolutionære hypotese?
- Hvor mange mol ioner frigives, når 0,27 mol CoCl2 opløses i vand?
- Atomfejl skaber overraskende, højeffektive UV LED-materialer
- Økonomiprofessor opdager angående effekter for olie- og gasboombyer


