Hvor mange elektroner har kvantetal værdier n l m?
kvantetal og elektronbeskrivelse
* n (hovedkvantetal): Bestemmer elektronens energiniveau. Det kan være ethvert positivt heltal (1, 2, 3, ...). Højere N -værdier betyder højere energiniveau.
* l (azimuthal eller vinkelmomentnummer): Beskriver formen på elektronens orbital og har værdier fra 0 til N-1.
* L =0:S Orbital (sfærisk)
* L =1:P orbital (håndvægtformet)
* L =2:D Orbital (mere komplekse former)
* l =3:f orbital (endnu mere komplekse former)
* m (magnetisk kvantenummer): Specificerer orienteringen af orbitalen i rummet. Det påtager sig heltalværdier fra -l til +l, inklusive 0. For eksempel, hvis l =1 (p orbital), kan m være -1, 0 eller +1, hvilket repræsenterer tre mulige orienteringer.
* s (spin kvantealnummer): Beskriver den iboende vinkelmoment for et elektron, ofte kaldet "spin." Det har to mulige værdier:+1/2 eller -1/2.
Pauli -ekskluderingsprincippet
Det centrale princip er Pauli -ekskluderingsprincippet :Ingen to elektroner i et atom kan have det samme sæt med alle fire kvantetal (N, L, M, S). Dette betyder, at hvert unikt sæt kvantetal kun kan beskrive en elektron.
eksempel
Lad os sige, at du har n =2, l =1. Dette beskriver en 2p orbital. Da L =1, kan m være -1, 0 eller +1. Dette betyder, at der er tre 2p orbitaler:
* 2p x (M =-1)
* 2p y (M =0)
* 2p z (M =+1)
Hver af disse orbitaler kan indeholde to elektroner (en med spin +1/2 og en med spin -1/2). Derfor har du i alt 6 elektroner (3 orbitaler * 2 elektroner pr. Orbital).
Kortfattet
For at bestemme, hvor mange elektroner der kan beskrives ved et sæt kvantetal (n, l, m), skal du følge disse trin:
1. Beregn antallet af orbitaler: Værdien af L bestemmer antallet af orbitaler (2L + 1).
2. Bestem elektronkapaciteten: Hver orbital kan indeholde maksimalt 2 elektroner.
3. Multiplicer for at finde de samlede elektroner: Det samlede antal elektroner er (2L + 1) * 2.
Vigtig note: Kvanteantal M påvirker ikke direkte antallet af elektroner. Det bestemmer orienteringen af orbitalen i rummet, hvilket er vigtigt for kemisk binding, men ikke påvirker den samlede elektronkapacitet.
Sidste artikelHvem klassificerede mineraler i henhold til deres kemiske sammensætning?
Næste artikelHvad er det glade kemikalie?
 Varme artikler
Varme artikler
-
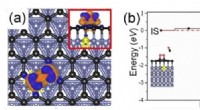 Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå (
Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå ( -
 Et skridt nærmere design on demand stilladser til vævsregenereringKelly Schultz, P.C. Rossin assisterende professor i kemi- og biomolekylær teknik, Lehigh Universitet. Kredit:Lehigh University Strukturen af tværbundne polymere geler ligner meget blødt væv - hv
Et skridt nærmere design on demand stilladser til vævsregenereringKelly Schultz, P.C. Rossin assisterende professor i kemi- og biomolekylær teknik, Lehigh Universitet. Kredit:Lehigh University Strukturen af tværbundne polymere geler ligner meget blødt væv - hv -
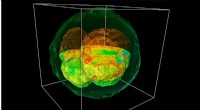 Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e
Ny mikroskopteknik afslører indre struktur af levende embryonerEt GLIM billede af et gengivet ko-embryo, der blev skåret gennem midten for at afsløre indre strukturer. Kredit:Billede udlånt af Gabriel Popescu Forskere fra University of Illinois har udviklet e -
 Bryde kæden - katalysere en grøn fremtid for kemiFig.1:TEM-billede af CeO2-understøttede ruthenium-nanopartikler katalysator. Gule cirkler viser Ru nanopartikler. Kredit:Osaka University Osaka Universitets forskere skaber katalysator til raffine
Bryde kæden - katalysere en grøn fremtid for kemiFig.1:TEM-billede af CeO2-understøttede ruthenium-nanopartikler katalysator. Gule cirkler viser Ru nanopartikler. Kredit:Osaka University Osaka Universitets forskere skaber katalysator til raffine
- OCT-baseret teknik fanger subtile detaljer om fotoreceptorfunktion
- Hvad er Kansas breddegrad og længdegrad?
- Franskmand forsøger at krydse Atlanterhavet i tøndekapsel
- Fremstilling af limonade:Tilfældig observation fører til undersøgelse af mikrobiel blomstringsdan…
- Hvordan gør Gorillas Mate?
- Sådan fungerer Black Hawk -helikoptere


