Hvor mange mol PCL5 kan produceres fra 58,0 g Cl2 (og overskydende P4)?
1. Afbalanceret kemisk ligning
Den afbalancerede kemiske ligning for reaktionen er:
P₄ + 10 cl₂ → 4 pcl₅
2. Konverter gram CL₂ til mol
* Find den molære masse af Cl₂:2 * 35,45 g/mol =70,90 g/mol
* Opdel massen af Cl₂ med dens molære masse:58,0 g / 70,90 g / mol =0,819 mol cl₂
3. Brug molforholdet fra den afbalancerede ligning
* Ligningen viser, at 10 mol Cl₂ producerer 4 mol PCL₅.
* Opret en andel:(0,819 mol cl₂) / (10 mol cl₂) =(x mol pcl₅) / (4 mol pcl₅)
4. Løs for X (mol PCL₅)
* Kryds-multipiply:0,819 mol cl₂ * 4 mol pcl₅ =10 mol cl₂ * x mol pcl₅
* Løs for x:x =(0,819 mol cl₂ * 4 mol pcl₅) / 10 mol cl₂
* Beregn:x =0,328 mol pcl₅
Svar: 0,328 mol PCL₅ kan produceres fra 58,0 g CL₂.
Sidste artikelEr det muligt at fremstille natriumnitrit fra bariumnitrit?
Næste artikelHvilket kemikalie står RH for?
 Varme artikler
Varme artikler
-
 Bakterie-dræbende glas giver håb i kampen mod hospitalsinfektionerKredit:CC0 Public Domain Forskere ved Aston University har opdaget en teknik, der ligner middelalderfremstilling af farvet glas, der fuldstændigt kan udrydde de mest dødelige hospitalsinfektioner
Bakterie-dræbende glas giver håb i kampen mod hospitalsinfektionerKredit:CC0 Public Domain Forskere ved Aston University har opdaget en teknik, der ligner middelalderfremstilling af farvet glas, der fuldstændigt kan udrydde de mest dødelige hospitalsinfektioner -
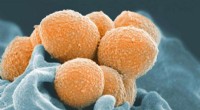 Forskning identificerer potentielle mål for strep A-vaccineEt scanningselektronmikroskopbillede af gruppe A Streptococcus (orange) under fagocytisk interaktion med en human neutrofil (blå). Kredit:NIAID De fleste mennesker tænker på strep hals som en rela
Forskning identificerer potentielle mål for strep A-vaccineEt scanningselektronmikroskopbillede af gruppe A Streptococcus (orange) under fagocytisk interaktion med en human neutrofil (blå). Kredit:NIAID De fleste mennesker tænker på strep hals som en rela -
 Forskere bygger første deployable, gå, blød robotIllustration af DeployBots, der installerer sig selv på en planet for at udforske rummet. Kredit:Wang et al. ©2017 Royal Society of Chemistry (Phys.org)—Forskere har bygget den første robot lavet
Forskere bygger første deployable, gå, blød robotIllustration af DeployBots, der installerer sig selv på en planet for at udforske rummet. Kredit:Wang et al. ©2017 Royal Society of Chemistry (Phys.org)—Forskere har bygget den første robot lavet -
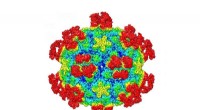 Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc
Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc
- Hvordan er molekylær form kritisk for et levende system?
- En blomsterbestøvningsalgoritme til effektiv planlægning af robotstier
- Sådan samles en komplet kæbe
- Dartmouth-forskere skaber ny nano-switch
- Et katalog over solstrømsinteraktioner
- Hvilket udtryk identificerer den proces, der bruges af celle til at bringe en stor molekyler ind?


