Er det muligt at fremstille natriumnitrit fra bariumnitrit?
Princip:
Reaktionen er afhængig af princippet om dobbeltfortrængning , hvor kationerne og anionerne af to reaktanter skifter partnere til at danne to nye produkter.
trin:
1. reaktion: Barium nitrit (BA (NO2) 2) reageres med natriumsulfat (Na2SO4) i en vandig opløsning.
2. nedbør: Reaktionen producerer uopløseligt bariumsulfat (BASO4) som et bundfald, mens natriumnitrit (NANO2) forbliver opløst i opløsningen.
3. adskillelse: Bundfaldet er adskilt fra opløsningen gennem filtrering.
4. Fordampning: Opløsningen indeholdende natriumnitrit fordampes for at opnå fast natriumnitrit.
Kemisk ligning:
BA (NO2) 2 (aq) + Na2SO4 (aq) → Baso4 (s) + 2 nano2 (aq)
Vigtige overvejelser:
* renhed af reaktanter: Brug af barium nitrit med høj renhed og natriumsulfat er afgørende for at opnå ren natriumnitrit.
* sikkerhedsforholdsregler: Bariumsalte er giftige, så ordentlige håndterings- og bortskaffelsesprocedurer er vigtige.
* Udbytte og effektivitet: Reaktionens udbytte og effektivitet afhænger af reaktionsbetingelserne og reaktanternes renhed.
alternativ metode:
En anden måde at opnå natriumnitrit er gennem reaktion af salpetersyre med natriumhydroxid efterfulgt af reduktion med et reduktionsmiddel som svovldioxid.
Bemærk: Fremstilling af natriumnitrit udføres generelt ikke i stor skala i hjemmelaboratorier på grund af sikkerhedsmæssige bekymringer og tilgængeligheden af let tilgængelige kommercielle natriumnitrit.
 Varme artikler
Varme artikler
-
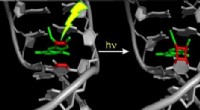 Belysning af reaktionsmekanismen ved PUVA-lysterapi til hudsygdommeReaktionsstadier, når et psoralenmolekyle binder til DNA. Resultatet er, at psoralen er permanent bundet til DNAet via en cyclobutanring. Cellen er ændret og dermed beskadiget, og udløser processen me
Belysning af reaktionsmekanismen ved PUVA-lysterapi til hudsygdommeReaktionsstadier, når et psoralenmolekyle binder til DNA. Resultatet er, at psoralen er permanent bundet til DNAet via en cyclobutanring. Cellen er ændret og dermed beskadiget, og udløser processen me -
 En ny prisbillig og letanvendelig teknologi til diagnose af tørre øjneKredit:Universidad Politécnica de Madrid UPM-forskere har udviklet en optisk biosensor med en nem, hurtig og overkommelig metode til udlæsning, der tillader in vitro-detektion af et biologisk mate
En ny prisbillig og letanvendelig teknologi til diagnose af tørre øjneKredit:Universidad Politécnica de Madrid UPM-forskere har udviklet en optisk biosensor med en nem, hurtig og overkommelig metode til udlæsning, der tillader in vitro-detektion af et biologisk mate -
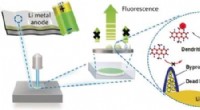 Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe
Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe -
 Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn
Vanilje får mælkedrikke til at virke sødereKredit:CC0 Public Domain Tilsætning af vanilje til sødet mælk får forbrugerne til at tro, at drikkevaren er sødere, gør det muligt at reducere mængden af tilsat sukker, ifølge forskere fra Penn
- Ville du stole på, at en myre amputerer dit lem? Videnskaben viser, at de er dygtige kirurger
- Forskere bruger magnetisk aktiverede mikrorobotter til at levere stamceller til vævsmål
- De indiske landsbyboere, der mistede deres hjem til havet
- Forskere demonstrerer ny metode til at høste energi fra lys
- Tror du, at klimaændringer er dårlige for majs? Tilføj ukrudt til ligningen
- Afslører, hvordan et embryos celler synkroniseres


