Hvad vil der ske, hvis magnesiumcarbonat reageres med en syre?
* magnesiumsalt (f.eks. Magnesiumchlorid, MGCL₂, hvis saltsyre anvendes)
* kuldioxidgas (co₂)
* vand (H₂O)
Her er en generel ligning for reaktionen:
mgco₃ (s) + 2Hx (aq) → mgx₂ (aq) + co₂ (g) + h₂o (l)
Hvor:
* HX repræsenterer enhver syre (f.eks. HCL, H₂so₄)
* MGX₂ repræsenterer det tilsvarende magnesiumsalt
Her er en sammenbrud af, hvad der sker:
1. syre giver H⁺ioner: Syren (HX) dissocierer i opløsning og frigiver hydrogenioner (H⁺).
2. carbonat reagerer med H⁺: Magnesiumcarbonatet reagerer med H⁺ionerne.
3. Dannelse af kuldioxid og vand: Carbonationer (co₃²⁻) kombineres med H⁺ioner for at danne carbonsyre (H₂CO₃), som er ustabil og nedbrydes hurtigt i kuldioxid og vand.
4. Magnesium saltdannelse: De resterende magnesiumioner (mg²⁺) fra magnesiumcarbonatet kombineres med anionerne (x⁻) fra syren for at danne et magnesiumsalt.
Observation:
Reaktionen ledsages typisk af:
* fizzing eller bobling: Dette skyldes frigivelse af kuldioxidgas.
* Varmeproduktion: Reaktionen er normalt eksoterm.
Eksempel:
Reaktionen af magnesiumcarbonat med saltsyre (HCI):
MGCO₃ (S) + 2HCI (AQ) → MGCL₂ (AQ) + CO₂ (G) + H₂O (L)
I dette tilfælde dannes magnesiumchlorid (MGCL₂) som magnesiumsalt.
Denne reaktion er et almindeligt eksempel på en syre-base-reaktion, hvor en base (magnesiumcarbonat) reagerer med en syre (saltsyre) til dannelse af salt (magnesiumchlorid), vand og kuldioxidgas.
Sidste artikelHvordan konverterer du SCFM -naturgas til MCF?
Næste artikelHvordan adskiller isotoper sig fra hinanden?
 Varme artikler
Varme artikler
-
 Oprydning af CO2 -emissioner kan være millioner værdSkematisk fremstilling af en mulig fremtidig C2CNT-station, der bruger solvarmeenergi til at omdanne kuldioxid fra atmosfæren til kulstof nanorøruld. Kredit:Johnson et al. © 2017 Elsevier Ltd. (Ph
Oprydning af CO2 -emissioner kan være millioner værdSkematisk fremstilling af en mulig fremtidig C2CNT-station, der bruger solvarmeenergi til at omdanne kuldioxid fra atmosfæren til kulstof nanorøruld. Kredit:Johnson et al. © 2017 Elsevier Ltd. (Ph -
 Forskere forvandler akvakulturaffald til nyt biomateriale til vævsreparationForskerne mener, at biomaterialet er et lovende alternativ til den nuværende standardpraksis med at bruge en patients eget væv, hvilket kræver yderligere operation til knogleudtrækning. På samme tid,
Forskere forvandler akvakulturaffald til nyt biomateriale til vævsreparationForskerne mener, at biomaterialet er et lovende alternativ til den nuværende standardpraksis med at bruge en patients eget væv, hvilket kræver yderligere operation til knogleudtrækning. På samme tid, -
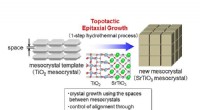 Fotokatalysator gør brintproduktion 10 gange mere effektivSyntese af SrTiOmeso-krystaller ved topotaktisk epitaksial vækst. Kredit:Kobe University Brint er en alternativ energikilde, der kan produceres fra vedvarende kilder til sollys og vand. En gruppe
Fotokatalysator gør brintproduktion 10 gange mere effektivSyntese af SrTiOmeso-krystaller ved topotaktisk epitaksial vækst. Kredit:Kobe University Brint er en alternativ energikilde, der kan produceres fra vedvarende kilder til sollys og vand. En gruppe -
 At forstå, hvordan en katalysator omdanner metan til ethen, kan forhindre flaring af naturgasDeponi brænder flare af. Kredit:Eddie Hagler/Public Domain Det ville være en tredobbelt sejr - for klimaet, råmaterialeressourcer, og den kemiske industri. Med deres arbejde, videnskabsfolk ved Fr
At forstå, hvordan en katalysator omdanner metan til ethen, kan forhindre flaring af naturgasDeponi brænder flare af. Kredit:Eddie Hagler/Public Domain Det ville være en tredobbelt sejr - for klimaet, råmaterialeressourcer, og den kemiske industri. Med deres arbejde, videnskabsfolk ved Fr
- Pludselig stratosfærisk opvarmning forbundet med åbent vand i polar ispose
- Hvordan bliver guld blandet i flodlejets sedimenter?
- CeCoIn5 afslører nye hemmeligheder om, hvordan superledning og magnetisme kan hænge sammen
- Kemikere udvikler urinprøve med papirstrimmel til evaluering derhjemme/på kontoret/klinikken
- Mystiske krusninger i Mælkevejen blev forårsaget af en forbipasserende dværggalakse
- Oprettelse af de største neutrinodetektorer i verden


