Hvad sker der i elektrokemisk celle for at få den til at gå fladt?
1. Udtømning af reaktanter:
* Elektrokemiske celler fungerer ved at omdanne kemisk energi til elektrisk energi. Denne proces involverer en kemisk reaktion mellem reaktanterne ved elektroderne.
* Efterhånden som reaktionen skrider frem, forbruges reaktanterne. Tænk på det som at brænde brændstof i en bil - til sidst løber du tør for benzin.
* Når reaktanterne er udtømt, stopper den kemiske reaktion. Dette betyder, at cellen ikke længere kan producere elektrisk energi, og den "går fladt."
2. Ligevægt:
* Elektrokemiske reaktioner er reversible. Dette betyder, at reaktionens produkter også kan reagere på dannelse af de originale reaktanter.
* Efterhånden som reaktionen fortsætter, øges koncentrationen af produkter, og koncentrationen af reaktanter falder.
* Til sidst bliver hastigheden for den fremadgående reaktion (reaktanter på produkter) lig med hastigheden for den modsatte reaktion (produkter til reaktanter). Dette kaldes ligevægt.
* Ved ligevægt er der ingen nettoændring i koncentrationen af reaktanter eller produkter. Dette betyder, at cellen ikke længere kan generere en potentiel forskel og derfor ingen strøm. Cellen er effektivt "flad" i denne tilstand.
Andre faktorer, der kan bidrage til en celle, der går fladt:
* intern modstand: Over tid kan den interne modstand af cellen stige på grund af faktorer som korrosion eller opbygning af reaktionsprodukter. Dette øger energitabet inden i cellen og reducerer dets output.
* Temperatur: Ekstreme temperaturer kan påvirke hastigheden for den kemiske reaktion og cellens ydeevne.
* lækage: Hvis cellen er beskadiget eller har en defekt tætning, kan den lække sin elektrolytopløsning, hvilket er vigtigt for de kemiske reaktioner.
Kortfattet: En elektrokemisk celle "går fladt", når dens reaktanter er udtømt, eller den når ligevægt. Dette skyldes de grundlæggende principper for kemiske reaktioner og omdannelsen af kemisk energi til elektrisk energi.
Sidste artikelHvad er der lavet af smelteplader?
Næste artikelHvordan kan du bevise, at en gas optager plads?
 Varme artikler
Varme artikler
-
 Perovskites – fremtidens materialer i optisk kommunikationFilmen i den nye perovskite overfører både tekst og billeder, hurtigt og pålideligt. Kredit:Thor Balkhed Forskere ved universiteterne i Linköping og Shenzhen har vist, hvordan en uorganisk perovsk
Perovskites – fremtidens materialer i optisk kommunikationFilmen i den nye perovskite overfører både tekst og billeder, hurtigt og pålideligt. Kredit:Thor Balkhed Forskere ved universiteterne i Linköping og Shenzhen har vist, hvordan en uorganisk perovsk -
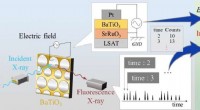 Fin struktur afsløret af potentielt alternativ til blyforbindelse, der bruges i sensorerFluorescensrøntgenstråler fra den tynde film BaTiO_3 detekteres af en solid state-detektor med tidsstempelinformation, som synkroniseres med den påførte spænding på filmen for at opnå tidsmæssig varia
Fin struktur afsløret af potentielt alternativ til blyforbindelse, der bruges i sensorerFluorescensrøntgenstråler fra den tynde film BaTiO_3 detekteres af en solid state-detektor med tidsstempelinformation, som synkroniseres med den påførte spænding på filmen for at opnå tidsmæssig varia -
 Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et
Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et -
 Træringe bruges til at modvirke smuglerringeDNA-analyse og nær-infrarøde scannere kunne hjælpe toldere med at identificere ulovligt handlet træ. Kredit:Pixabay/ Kytalpa Analyse af regionale forskelle i træets DNA og har givet forskere mulig
Træringe bruges til at modvirke smuglerringeDNA-analyse og nær-infrarøde scannere kunne hjælpe toldere med at identificere ulovligt handlet træ. Kredit:Pixabay/ Kytalpa Analyse af regionale forskelle i træets DNA og har givet forskere mulig
- Indonesien Anak Krakatau vulkan skyder aske, lava
- Størrelse 4,9 efterskælv i Californiens jordskælv føltes bredt
- Hvad betyder udtrykket øre til jord?
- Anvendelser af vedvarende energikilder
- Kan en forståelse af ejernes adfærd forbedre sundheden og velfærden for heste?
- Hvordan påvirker klimaændringer havets vand og økosystemer?


