Forekommer forskydningsreaktioner kun mellem halogener?
Her er en sammenbrud:
forskydningsreaktioner:
* Generel definition: En forskydningsreaktion involverer udskiftning af et element eller ion i en forbindelse med et andet element eller ion. Dette forekommer typisk, når et mere reaktivt element eller ion fortrænger et mindre reaktivt.
* Typer af forskydningsreaktioner:
* enkelt forskydning: Et enkelt element fortrænger et element fra en forbindelse.
* Eksempel:Zn (s) + cuso₄ (aq) → znso₄ (aq) + cu (s) (zink fortrænger kobber)
* Dobbeltfortrængning: To forbindelser udveksler ioner.
* Eksempel:Agno₃ (aq) + NaCl (aq) → AgCl (s) + nano₃ (aq) (sølv- og natriumioner udvekslingssteder)
Halogenfortrængning:
* reaktivitet: Halogener er meget reaktive ikke -metaller, og deres reaktivitet falder, når du bevæger dig ned ad den periodiske tabel (f> cl> br> i).
* forskydningsreaktioner: En mere reaktiv halogen kan fortrænge en mindre reaktiv halogen fra en forbindelse.
* Eksempel:CL₂ (G) + 2NABR (AQ) → 2NACL (AQ) + BR₂ (L) (klor fortrænger brom)
ud over halogener:
* Metaller: Flere reaktive metaller kan fortrænge mindre reaktive metaller fra deres forbindelser.
* Eksempel:Fe (s) + cuso₄ (aq) → feso₄ (aq) + cu (s) (jern fortrænger kobber)
* ikke -metaller: Nogle ikke -metaller kan også deltage i forskydningsreaktioner.
* Eksempel:C (S) + H₂O (G) → CO (G) + H₂ (G) (kulstoffortræder brint)
Sammenfattende er forskydningsreaktioner en bred kategori af kemiske reaktioner, der kan involvere forskellige elementer og forbindelser, ikke kun halogener. Nøglefaktoren er den relative reaktivitet af de involverede elementer eller ioner.
 Varme artikler
Varme artikler
-
 Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me
Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me -
 Ny dyb-læringstilgang forudsiger proteinstruktur fra aminosyresekvensAminosyren selenocystein, 3D-bolde model. Kredit:YassineMrabet/CC BY 3.0/Wikipedia Næsten alle grundlæggende biologiske processer, der er nødvendige for liv, udføres af proteiner. De skaber og ved
Ny dyb-læringstilgang forudsiger proteinstruktur fra aminosyresekvensAminosyren selenocystein, 3D-bolde model. Kredit:YassineMrabet/CC BY 3.0/Wikipedia Næsten alle grundlæggende biologiske processer, der er nødvendige for liv, udføres af proteiner. De skaber og ved -
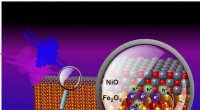 Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid
Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid -
 Bakteriefabrikker kunne fremstille højtydende proteiner til rummissionerKonstruerede bakterier producerer edderkoppesilkeproteiner, der kan spindes til stærke fibre (øverst; tværsnit med større forstørrelse nederst). Kredit:Christopher Bowen Naturen har udviklet prote
Bakteriefabrikker kunne fremstille højtydende proteiner til rummissionerKonstruerede bakterier producerer edderkoppesilkeproteiner, der kan spindes til stærke fibre (øverst; tværsnit med større forstørrelse nederst). Kredit:Christopher Bowen Naturen har udviklet prote
- Hvad er et eksempel på en teknologi, der hjælper med at understøtte ideen kontinental drift, hvil…
- Forskere identificerer nye arter af forhistorisk krokodille
- Enhed dirigerer sædcellerne til at gå imod strømmen for at hjælpe med infertilitet
- Potentielt eksplosiv metangas mobil i grundvand, udgør sikkerhedsrisiko:undersøgelse
- Hvor gode er tests for E. coli i vandløb?
- Facebook ramte med gruppesøgsmål over ansigtsgenkendelsesværktøj


