Sammenlign den relative lethed af oxidationsprimær sekundær og tertiær butylalkohol mod syre -dichromat baseret på tid, der kræves til opløsning til at ændre farve?
Forståelse af oxidationsprocessen
* Acid Dichromate: Kaliumdichromat (k₂cr₂o₇) i sur opløsning er et stærkt oxidationsmiddel. Det bruges ofte til at oxidere alkoholer.
* farveændring: Dichromate -ion (cr₂o₇²⁻) er orange i farve. Når det fungerer som en oxidationsmiddel, reduceres den til den grønne cr³⁺ -ion. Denne farveændring fra orange til grøn er en visuel indikator for oxidationsreaktionen.
oxidation lethed og tid
* primære alkoholer (som butan-1-ol): Disse er de nemmeste at oxidere. De kan oxideres til aldehyder og derefter videre til carboxylsyrer.
* Tid: Løsningen ændrer farve relativt hurtigt på grund af let oxidation.
* sekundære alkoholer (som butan-2-ol): Disse kan oxideres til ketoner.
* Tid: Oxidationen er langsommere end med primære alkoholer. Det kan tage lidt længere tid, før løsningen ændrer farve.
* tertiære alkoholer (som 2-methylpropan-2-ol): Tertiære alkoholer kan ikke blive oxideret med syredikromat. De mangler hydrogenatomet fastgjort til det kulstof, der bærer den hydroxylgruppe, der kræves til oxidationsprocessen.
* Tid: Løsningen ændrer ikke farve, fordi der ikke opstår nogen oxidationsreaktion.
Hvorfor forskellen?
Det lette oxidation bestemmes af stabiliteten af carbocation -mellemproduktet dannet under reaktionen.
* primære alkoholer: Form relativt ustabile carbocations.
* sekundære alkoholer: Danner mere stabile carbocations.
* tertiære alkoholer: Form de mest stabile carbokationer, men processen er ikke mulig med syredikromat på grund af manglen på et hydrogenatom på carbon, der bærer hydroxylgruppen.
resume
Den relative lette oxidation med syredikromat følger denne rækkefølge:
1. Primære alkoholer> Sekundære alkoholer> Tertiære alkoholer (ikke oxideret)
Dette afspejles i den tid, det tager for løsningen at ændre farve, med primære alkoholer, der forårsager den hurtigste ændring og tertiære alkoholer, der ikke forårsager nogen ændring.
Sidste artikel1 Hvordan ved du, at to stoffer får forskellige anklager, når de gnides sammen?
Næste artikelHvad bruges radium til i dag?
 Varme artikler
Varme artikler
-
 Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet
Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet -
 Meteoritnedslag kan skabe uventede former for silicaRøntgendiffraktionsbilleder, der viser den nye form for silica skabt ved at sende en intens stødbølge gennem en prøve af kvarts ved hjælp af en specialiseret gaspistol. Når røntgenstrålerne preller af
Meteoritnedslag kan skabe uventede former for silicaRøntgendiffraktionsbilleder, der viser den nye form for silica skabt ved at sende en intens stødbølge gennem en prøve af kvarts ved hjælp af en specialiseret gaspistol. Når røntgenstrålerne preller af -
 At finde grønne opløsningsmidler til trykt elektronikFysikforskere har udviklet og offentliggjort et åbent webværktøj til let identifikation af grønne opløsningsmidler til trykt elektronik. Kredit:Joan Ràfols-Ribé Det nye felt inden for trykt elektr
At finde grønne opløsningsmidler til trykt elektronikFysikforskere har udviklet og offentliggjort et åbent webværktøj til let identifikation af grønne opløsningsmidler til trykt elektronik. Kredit:Joan Ràfols-Ribé Det nye felt inden for trykt elektr -
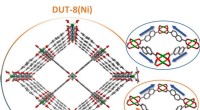 Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
- Hvad er den nærmeste stjerne på Jorden om natten?
- Hvad ville få en motor til at dreje hurtigere?
- Leids økonofysiske model testet bedst af centralbanker
- Blande moderne materialer? NIST matematik app hjælper dig med at administrere din mashup
- Simuleringer afslører rolle af calcium i titanium implantat accept
- Kinas energipolitik skal afbalancere luftkvaliteten, kulstofemissioner og mål for vandmangel


