Hvorfor kemikere bruger procent efter volumen til at forberede og beskrive mange løsninger, de bruger?
* enkelhed: Det er ligetil at beregne og forstå. Du opdeler blot mængden af opløstelsen med det samlede volumen af opløsningen og multiplicerer med 100%.
* direkte relatabel: Procent efter volumen relaterer direkte mængden af opløst stof til det samlede volumen af opløsningen, hvilket gør det lettere at visualisere koncentrationen. For eksempel betyder en 10% V/V -opløsning, at 10 ml opløst stof er til stede i hver 100 ml opløsning.
* praktisk til væsker: Det er især nyttigt til løsninger, hvor både opløst og opløsningsmiddel er væsker, da det direkte afspejler volumenforholdet mellem de to.
* Velegnet til fortyndinger: Det er relativt let at fortynde løsninger, der er fremstillet efter volumen. Brug blot det passende volumenforhold til at opnå den ønskede koncentration.
Imidlertid er der nogle begrænsninger for at bruge procent efter volumen:
* Temperaturafhængighed: Volumen er temperaturafhængig. Hvis opløsningens temperatur ændres, ændres volumenet af både opløst stof og opløsningsmiddel, hvilket potentielt ændrer koncentrationen.
* ikke ideel til faste stoffer eller gasser: Det er mindre nyttigt til løsninger, hvor opløsningen er en solid eller en gas. Mængden af en fast eller gas kan variere meget med tryk og temperatur, hvilket gør det mindre pålideligt for nøjagtigt at repræsentere koncentration.
alternativer til procent efter volumen:
* procent efter masse (% w/w): Dette er mere nøjagtigt for faste stoffer og gasser, da masse er en mere pålidelig foranstaltning end volumen.
* Molaritet (M): Dette udtrykker koncentration som mol af opløst stof pr. Liter opløsning, hvilket gør den ideel til reaktioner og støkiometri.
Samlet set, mens procent efter volumen har sine begrænsninger, forbliver det et værdifuldt værktøj for kemikere, især til fremstilling og beskrivelse af løsninger, hvor både opløst og opløsningsmiddel er væsker.
Sidste artikelGiv dig fem erhverv, der bruger kemi?
Næste artikelEr NA BR en molekylær formel eller enhed?
 Varme artikler
Varme artikler
-
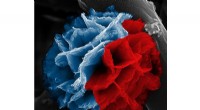 Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve
Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve -
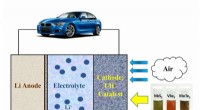 2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier,
2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier, -
 Oprydning af undergrundsbaner:Sandias 20-årige mission for at stoppe miltbrandSandia National Laboratories ingeniør Mark Tucker holder en prøve af dekontamineringsskum modificeret til at klæbe til vægge og lofter i undergrundstunneler. Tucker har brugt meget af de sidste 20 år
Oprydning af undergrundsbaner:Sandias 20-årige mission for at stoppe miltbrandSandia National Laboratories ingeniør Mark Tucker holder en prøve af dekontamineringsskum modificeret til at klæbe til vægge og lofter i undergrundstunneler. Tucker har brugt meget af de sidste 20 år -
 En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente
En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente
- Forskere optimerer ydeevnen af nye organiske elektrokemiske transistorer
- Hvordan kan plader bevæge sig fra hinanden ved de midterste havrygge og ikke efterlade et dybt hul …
- Hvordan vision fungerer
- Kompakte højttalersystemer dirigerer lyden effektivt
- Hvad er en indikatororganismer?
- Carbon in a twirl:Videnskaben bag en selvsamlet nano-carbon helix


