Hvad ville reducere reaktanthastigheden?
Faktorer, der påvirker reaktionshastigheden:
* Sænkning af koncentrationen af reaktanter: Jo mere koncentreret reaktanterne er, desto hyppigere vil kollisioner forekomme, hvilket fører til en højere reaktionshastighed. Sænkning af koncentrationen reducerer disse kollisioner.
* Faldende temperaturen: Temperatur giver energien til molekyler til at overvinde aktiveringsenergi og reagere. Sænkning af temperaturen bremser molekylær bevægelse ned, hvilket reducerer hyppigheden og energien af kollisioner.
* Forøgelse af aktiveringsenergien: Aktiveringsenergi er den minimale energi, der kræves for reaktanter til at danne produkter. At hæve aktiveringsenergien gør det sværere for reaktanter at overvinde denne barriere og bremse reaktionen.
* Tilføjelse af en katalysator (omvendt): Katalysatorer fremskynder reaktioner ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi. Fjernelse af en katalysator eller anvendelse af en hæmmer vil have den modsatte effekt.
* Forøgelse af overfladearealet af faste stoffer: For reaktioner, der involverer faste stoffer, giver øget overfladeareal (f.eks. Ved at slibe et fast stof i mindre partikler) flere kontaktpunkter for reaktanter at interagere. Faldende overfladeareal har den modsatte effekt.
* Ændring af reaktanternes fase: Reaktioner i gasfasen fortsætter generelt hurtigere end dem i flydende fase, som er hurtigere end dem i den faste fase. Ændring af fasen fra en mere mobil til en mindre mobil tilstand vil reducere reaktionshastigheden.
Vigtige overvejelser:
* reaktionsordre: Den specifikke virkning af disse faktorer på reaktionshastighed afhænger af rækkefølgen af reaktionen (hvordan hastigheden afhænger af koncentrationen af hver reaktant).
* ligevægt: Mens disse faktorer påvirker reaktionshastigheden, påvirker de også ligevægtens position.
Eksempel:
Forestil dig en reaktion, hvor to molekyler er nødt til at kollidere for at reagere. Sænkning af koncentrationen af en reaktant betyder, at der er færre molekyler til rådighed for at kollidere, hvilket reducerer chancerne for en vellykket reaktion.
Kortfattet:
For at reducere hastigheden for en reaktant kan du manipulere faktorer, der påvirker hyppigheden og energien på kollisioner mellem reaktantmolekyler, eller ændre den vej, som reaktionen tager for at gøre det vanskeligere at overvinde aktiveringsenergibarrieren.
Sidste artikelForklar hvad der bestemmer viskositeten af en væske?
Næste artikelHvilke forbindelser indeholder elementet uran?
 Varme artikler
Varme artikler
-
 Brug af kvanteprikker og en smartphone til at finde dræberbakterierForskerne Anwar Sunna (til højre) og Vinoth Kumar Rajendran med deres smartphone-aktiverede MRSA-detektor. Kredit:Sunna Lab En kombination af quantum dot nanoteknologi og et smartphonekamera kan s
Brug af kvanteprikker og en smartphone til at finde dræberbakterierForskerne Anwar Sunna (til højre) og Vinoth Kumar Rajendran med deres smartphone-aktiverede MRSA-detektor. Kredit:Sunna Lab En kombination af quantum dot nanoteknologi og et smartphonekamera kan s -
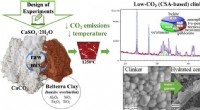 Alternativ cement med lavt CO2-fodaftryk udvikletGrafisk abstrakt. Kredit:DOI:10.1016/j.susmat.2021.e00299 Forskere ved Martin Luther University Halle-Wittenberg (MLU) i Tyskland og det brasilianske universitet i Pará har udviklet et klimavenlig
Alternativ cement med lavt CO2-fodaftryk udvikletGrafisk abstrakt. Kredit:DOI:10.1016/j.susmat.2021.e00299 Forskere ved Martin Luther University Halle-Wittenberg (MLU) i Tyskland og det brasilianske universitet i Pará har udviklet et klimavenlig -
 Kemiluminescensprober til hurtig og følsom påvisning af salmonella og listeriaKredit:CC0 Public Domain Salmonella og listeria er blandt de mest udbredte og dødeligste årsager til fødevarebårne infektioner. Deres hurtige og pålidelige registrering af fødevarer og industrielt
Kemiluminescensprober til hurtig og følsom påvisning af salmonella og listeriaKredit:CC0 Public Domain Salmonella og listeria er blandt de mest udbredte og dødeligste årsager til fødevarebårne infektioner. Deres hurtige og pålidelige registrering af fødevarer og industrielt -
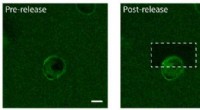 Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b
Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b


