Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknik
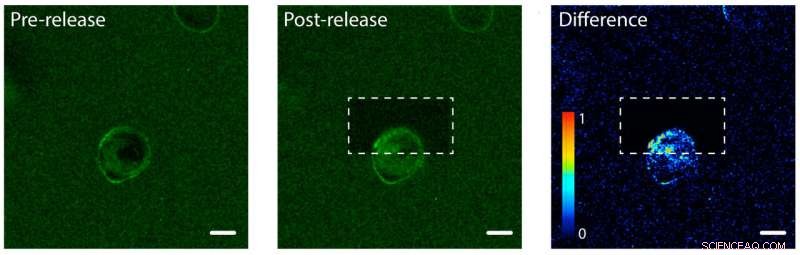
Fotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen binder EGF, gør dens membran grøn. Midten:Hydrogelen efter brug af en laser til at løsne og frigive EGF-proteiner på den øverste del af cellen. Til højre:Et billede, der viser forskellen i grøn fluorescerende farve mellem post- og pre-release billeder. Bemærk stigningen i farve i den øverste del af cellen, hvilket indikerer, at cellen er begyndt at internalisere de ubundne EGF-proteiner, men kun på den ene side. Skalaen er 10 mikrometer. Kredit:Shadish, Benuska og DeForest, 2019, Naturmaterialer
Vævsteknik kunne transformere medicin. I stedet for at vente på, at vores kroppe vokser igen eller reparerer skader efter en skade eller sygdom, videnskabsmænd kunne blive komplekse, fuldt funktionelle væv i et laboratorium til transplantation til patienter.
Proteiner er nøglen til denne fremtid. I vores kroppe, proteinsignaler fortæller cellerne, hvor de skal hen, hvornår man skal dele og hvad man skal gøre. I laboratoriet, forskere bruger proteiner til det samme formål - at placere proteiner på bestemte punkter på eller inden for konstruerede stilladser, og derefter bruge disse proteinsignaler til at kontrollere cellemigration, division og differentiering.
Men proteiner i disse indstillinger er også skrøbelige. For at få dem til at klæbe til stilladserne, forskere har traditionelt modificeret proteiner ved hjælp af kemi, der dræber mere end 90 procent af deres funktion. I et papir offentliggjort 20. maj i tidsskriftet Naturmaterialer , et team af forskere fra University of Washington afslørede en ny strategi for at holde proteiner intakte og funktionelle ved at ændre dem på et bestemt tidspunkt, så de kan bindes kemisk til stilladset ved hjælp af lys. Da tøjret også kan skæres af med laserlys, denne metode kan skabe udviklende mønstre af signalproteiner gennem et biomateriale stillads for at dyrke væv, der består af forskellige typer celler.
"Proteiner er de ultimative formidlere af biologisk information, " sagde den tilsvarende forfatter Cole DeForest, en UW assisterende professor i kemiteknik og bioteknik, samt en affiliate investigator med UW Institute for Stem Cell &Regenerative Medicine. "De driver stort set alle ændringer i cellefunktion - differentiering, bevægelse, vækst, død."
Af den grund, forskere har længe brugt proteiner til at kontrollere cellevækst og differentiering i vævsteknologi.
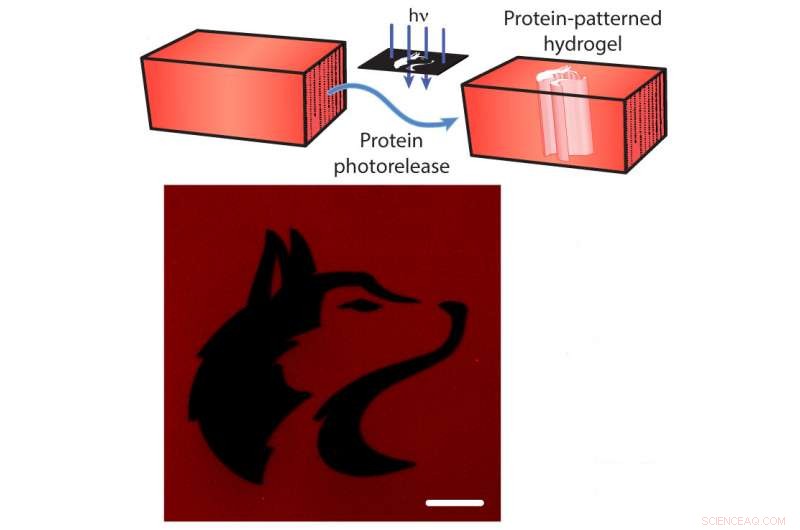
Fotofrigivelse af proteiner fra en hydrogel. Top:De røde fluorescerende mCherry -proteiner bindes til hydrogel. Forskere kan kløve tøjret med rettet lys (blå pile), frigivelse af mCherry fra hydrogelen (blå pile). Nederst:Et billede af hydrogelen efter mCherry-udgivelse mønstret i form af University of Washington-maskot (sort). Skalaen er 100 mikrometer. Kredit:Shadish, Benuska og DeForest, 2019, Naturmaterialer.
"Men den kemi, der oftest bruges af samfundet til at binde proteiner til materialer, herunder stilladser til vævsteknologi, ødelægge det overvældende flertal af deres funktion, " sagde DeForest, som også er fakultetsmedlem i UW Molecular &Engineering Sciences Institute. "Historisk set, forskere har forsøgt at kompensere for dette ved blot at overbelaste stilladset med proteiner, vel vidende, at de fleste af dem vil være inaktive. Her, Vi har fundet frem til en generaliserbar måde at funktionalisere biomaterialer reversibelt med proteiner og samtidig bevare deres fulde aktivitet."
Deres tilgang bruger et enzym kaldet sortase, som findes i mange bakterier, at tilføje et kort syntetisk peptid til hvert signalprotein på et specifikt sted:C-terminalen, et websted til stede på hvert protein. Holdet designer det peptid, så det vil binde signalproteinet til specifikke steder i et væskefyldt biomateriale-stillads, der er almindeligt inden for vævsteknologi, kendt som en hydrogel.
Målretning mod et enkelt sted på signalproteinet er det, der adskiller UW-teamets tilgang. Andre metoder modificerer signalproteiner ved at knytte kemiske grupper til tilfældige steder, hvilket ofte forstyrrer proteinets funktion. Ændring af blot C-terminalen af proteinet er meget mindre tilbøjelig til at forstyrre dets funktion, ifølge DeForest. Holdet testede tilgangen på mere end et halvt dusin forskellige typer proteiner. Resultater viser, at ændring af C-terminalen ikke har nogen signifikant effekt på proteinfunktionen, og binder med succes proteinerne gennem hydrogelen.
Deres tilgang er analog med at hænge et stykke indrammet kunst på en væg. I stedet for at hamre søm tilfældigt gennem glasset, lærred og ramme, de snor en enkelt ledning hen over bagsiden af hver ramme for at hænge den på væggen.
Ud over, tøjrene kan skæres ved at udsætte dem for fokuseret laserlys, forårsager "fotofrigivelse" af proteinerne. Ved at bruge denne videnskabelige lyssabel tillader forskerne at fylde en hydrogel med mange forskellige typer proteinsignaler, og udsæt derefter hydrogelen for laserlys for at fjerne proteiner fra visse dele af hydrogelen. Ved selektivt kun at udsætte dele af materialerne for laserlyset, holdet kontrollerede, hvor proteinsignaler ville forblive bundet til hydrogel.

Venstre til højre:Cole DeForest, Gabrielle Benuska, Jared Shadish. Kredit:Dennis Wise/University of Washington
Afbinding af proteiner er nyttig i hydrogeler, fordi celler derefter kan optage disse signaler, bringe dem ind i cellens indre, hvor de kan påvirke processer som genekspression.
DeForests team testede fotofrigivelsesprocessen ved hjælp af en hydrogel fyldt med epidermal vækstfaktor, en type proteinsignal. De introducerede en human cellelinje i hydrogelen og observerede vækstfaktorerne, der binder til cellemembranerne. Holdet brugte en laserstråle til at løsne proteinsignalerne på den ene side af en individuel celle, men ikke den anden side. På den forbundne side af cellen, proteinerne blev på ydersiden af cellen, da de stadig sad fast på hydrogelen. På den ubundne side, proteinsignalerne blev internaliseret af cellen.
"Baseret på, hvordan vi målretter laserlyset, vi kan sikre, at forskellige celler - eller endda forskellige dele af enkeltceller - modtager forskellige miljøsignaler, " sagde DeForest.
Dette unikke niveau af præcision i en enkelt celle hjælper ikke kun med vævsteknologi, men med grundforskning i cellebiologi, tilføjet DeForest. Forskere kunne bruge denne platform til at studere, hvordan levende celler reagerer på flere kombinationer af proteinsignaler, for eksempel. Denne forskningslinje ville hjælpe videnskabsmænd med at forstå, hvordan proteinsignaler arbejder sammen for at kontrollere celledifferentiering, helbrede sygt væv og fremme menneskelig udvikling.
"Denne platform giver os mulighed for præcist at kontrollere, hvornår og hvor bioaktive proteinsignaler præsenteres for celler i materialer, " sagde DeForest. "Det åbner døren til mange spændende anvendelser inden for vævsteknologi og terapeutisk forskning."
 Varme artikler
Varme artikler
-
 Forskere opdager forviklinger af serotoninreceptorer, der er afgørende for bedre behandlingLægemidler varierer i deres evne til at aktivere 5-HT2B serotoninreceptoren. Nogle lægemidler (RØD) aktiverer kraftigt receptoren og forårsager potentielt livstruende hjerteklapsygdomme, mens andre ku
Forskere opdager forviklinger af serotoninreceptorer, der er afgørende for bedre behandlingLægemidler varierer i deres evne til at aktivere 5-HT2B serotoninreceptoren. Nogle lægemidler (RØD) aktiverer kraftigt receptoren og forårsager potentielt livstruende hjerteklapsygdomme, mens andre ku -
 Er evnen til at opløse metaller en fysisk eller kemisk egenskab?Opløsning af metaller er en kemisk egenskab, der finder sted, når vand eller stærke syrer reagerer med metalliske genstande. Kemiske kræfter trækker metalatomer fra genstanden, hvilket får den til at
Er evnen til at opløse metaller en fysisk eller kemisk egenskab?Opløsning af metaller er en kemisk egenskab, der finder sted, når vand eller stærke syrer reagerer med metalliske genstande. Kemiske kræfter trækker metalatomer fra genstanden, hvilket får den til at -
 Zeolitkatalysatorer baner vejen til decentrale kemiske processerZeolit-katalyse reducerer væsentligt temperatur- og energibehovet i et nøgletrin i den kemiske proces til fremstilling af biobrændstof fra organisk affald. Dr. Yue Liu, Teresa Schachtl og Daniel Melze
Zeolitkatalysatorer baner vejen til decentrale kemiske processerZeolit-katalyse reducerer væsentligt temperatur- og energibehovet i et nøgletrin i den kemiske proces til fremstilling af biobrændstof fra organisk affald. Dr. Yue Liu, Teresa Schachtl og Daniel Melze -
 Deadlines for plastgenanvendelse tårner sig op – vil virksomheder opfylde deres mål?Kredit:Unsplash/CC0 Public Domain Mange af verdens største forbrugerproduktvirksomheder, inklusive kakao-cola, Unilever og PepsiCo, har sat ambitiøse mål for at erstatte jomfruelig plast med genan
Deadlines for plastgenanvendelse tårner sig op – vil virksomheder opfylde deres mål?Kredit:Unsplash/CC0 Public Domain Mange af verdens største forbrugerproduktvirksomheder, inklusive kakao-cola, Unilever og PepsiCo, har sat ambitiøse mål for at erstatte jomfruelig plast med genan
- Hvad er grundlaget for undtagelser fra Aufbau-princippet?
- Kunstig tunge kan skelne mellem whisky
- VW, Ford går sammen om at gøre autonome, elektriske køretøjer
- Sloveniens økohelt, der knuste en cementgigant
- Metan i fanerne på Saturns måne Enceladus:Mulige tegn på liv?
- Lennon eller McCartney? Kan statistisk analyse løse et forfatterskabspuslespil?


