Hvad er tre grunde til, at atomer binder?
1. for at opnå en stabil elektronkonfiguration: Atomer er mest stabile, når deres yderste elektronskal (Valence Shell) er fyldt. Ved at binde med andre atomer kan de enten vinde, miste eller dele elektroner for at opnå denne stabile konfiguration, der ligner de ædle gasser. Dette kaldes ofte "Octet -reglen", hvor atomer sigter mod otte elektroner i deres valensskal.
2. for at sænke deres potentielle energi: Limning frigiver energi, hvilket gør det resulterende molekyle mere stabil og lavere i potentiel energi sammenlignet med de individuelle, ubundne atomer. Denne energiudgivelse er drivkraften bag dannelsen af obligationer.
3. for at opnå en mere gunstig balance mellem attraktive og frastødende kræfter: Atomer indeholder både positivt ladede kerner og negativt ladede elektroner. Når atomer nærmer sig hinanden, er der en balance mellem attraktive kræfter (mellem kernen i det ene atom og den anden elektroner) og frastødende kræfter (mellem kernerne i både atomer og mellem elektronerne i begge atomer). Binding opstår, når de attraktive kræfter opvejer de frastødende kræfter, hvilket fører til en attraktiv netto attraktiv interaktion.
 Varme artikler
Varme artikler
-
 Oleo Sponge succesfuld under virkelige forhold ud for Californiens kystEt team af Argonne-forskere testede med succes Oleo-svampen ud for det sydlige Californiens kyst i april. Fra venstre mod højre:Argonnes Seth Darling, Jeff Elam og Ed Barry. Kredit:Argonne National La
Oleo Sponge succesfuld under virkelige forhold ud for Californiens kystEt team af Argonne-forskere testede med succes Oleo-svampen ud for det sydlige Californiens kyst i april. Fra venstre mod højre:Argonnes Seth Darling, Jeff Elam og Ed Barry. Kredit:Argonne National La -
 Forskergruppen skaber hydrogellim til at forsegle sårKredit:Harvard University En Band-Aid klæbende bandage er en effektiv måde at stoppe blødning fra hudskader, men en lige så levedygtig mulighed for intern blødning findes endnu ikke. Kirurgiske li
Forskergruppen skaber hydrogellim til at forsegle sårKredit:Harvard University En Band-Aid klæbende bandage er en effektiv måde at stoppe blødning fra hudskader, men en lige så levedygtig mulighed for intern blødning findes endnu ikke. Kirurgiske li -
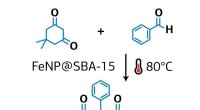 Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an -
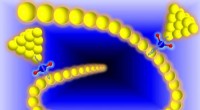 Forskere skabte et lille kredsløb gennem et enkelt vandmolekyleKredit:Limin Xiang, Arizona State University Vand, den ydmyge kombination af brint og ilt, er afgørende for livet. På trods af sin centrale plads i naturen, Man ved relativt lidt om den rolle, enk
Forskere skabte et lille kredsløb gennem et enkelt vandmolekyleKredit:Limin Xiang, Arizona State University Vand, den ydmyge kombination af brint og ilt, er afgørende for livet. På trods af sin centrale plads i naturen, Man ved relativt lidt om den rolle, enk
- Hvilke regler skal du følge være en videnskabsmand?
- Venturekapital ser ud til at være i fuld udbredelse men er det for meget snart?
- Hvordan koffein virker
- Tre typer globale opvarmningsårsager
- Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetid
- Ring af ild solformørkelse for at dæmpe Afrika, Asien


