Hvad er liganderne til stede i en uorganisk kompleks forbindelse?
Her er en sammenbrud af almindelige ligander:
Typer af ligander:
* monodentat: Disse ligander binder til metalatomet gennem et enkelt donoratom. Eksempler inkluderer:
* halogener: Cl-, br-, i-
* Vand: H2O
* ammoniak: NH3
* carbonmonoxid: Co
* cyanid: Cn-
* bidentat: Disse ligander har to donoratomer, der kan binde til metalatomet. Eksempler inkluderer:
* ethylendiamin: da (NH2CH2CH2NH2)
* Oxalat: C2O42-
* glycinat: H2nch2coo-
* polydentat: Disse ligander har mere end to donoratomer, der kan binde til metalatomet. Eksempler inkluderer:
* ethylendiaminetetraacetat: EDTA4- (en hexadentatligand)
* Porphyriner: (til stede i heme, chlorophyll)
ligand -nomenklatur:
* Ligander udnævnes efter deres identitet. For eksempel:
* aqua: H2O
* ammin: NH3
* chloro: Cl-
* cyano: Cn-
* Oxalato: C2O42-
* Antallet af ligander er angivet med præfikser såsom:
* mono: En
* di: To
* tri: Tre
* tetra: Fire
* penta: Fem
* hexa: Seks
Eksempler på uorganiske komplekse forbindelser:
* tetraammineCopper (II) sulfat: [Cu (NH3) 4] SO4
* Ligander:Ammoniak (NH3)
* kalium hexacyanoferrat (II): K4 [Fe (CN) 6]
* Ligander:Cyanid (CN-)
* tetraaquacopper (II) ion: [Cu (H2O) 4] 2+
* Ligander:vand (H2O)
Vigtige noter:
* Antallet og typen af ligander kan påvirke kompleksets egenskaber væsentligt.
* Ligander kan være neutrale, negativt ladede (anioniske) eller sjældent, positivt ladet (kationisk).
* Det centrale metalatom eller ion har typisk et koordinationsnummer, der repræsenterer antallet af ligander, der er direkte bundet til det.
At forstå liganderne i uorganiske komplekse forbindelser er afgørende for at forstå deres struktur, binding og reaktivitet.
 Varme artikler
Varme artikler
-
 Gør blyrør sikreKort påføring af elektricitet på et blyrør muliggør hurtigt en sikker belægning inde i røret. Kredit:Gabriel Lobo Udvaskning af bly fra rør ind i vandforsyningen er en alvorlig bekymring for folke
Gør blyrør sikreKort påføring af elektricitet på et blyrør muliggør hurtigt en sikker belægning inde i røret. Kredit:Gabriel Lobo Udvaskning af bly fra rør ind i vandforsyningen er en alvorlig bekymring for folke -
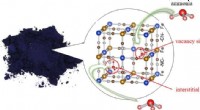 Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker -
 Smart label kunne en dag fortælle dig, hvornår du skal smide mad og kosmetikSmarte etiketter til kosmetik og fødevarer kunne en dag fortælle forbrugerne, hvornår de skal smide et produkt ud. Kredit:Silvana Andreescu Detektering af mad og kosmetisk fordærv og forurening. I
Smart label kunne en dag fortælle dig, hvornår du skal smide mad og kosmetikSmarte etiketter til kosmetik og fødevarer kunne en dag fortælle forbrugerne, hvornår de skal smide et produkt ud. Kredit:Silvana Andreescu Detektering af mad og kosmetisk fordærv og forurening. I -
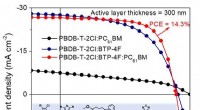 Over 14% effektivitet for ternære organiske solceller med 300 nm tykt aktivt lagJ-V-karakteristika for OSCer baseret på PBDB-T-2Cl:BTP-4F, PBDB-T-2Cl:PC61BM og PBDB-T-2Cl:BTP-4F:PC61BM; de kemiske strukturer af aktive lagkomponenter. Kredit:© Science China Press En tykfilm (3
Over 14% effektivitet for ternære organiske solceller med 300 nm tykt aktivt lagJ-V-karakteristika for OSCer baseret på PBDB-T-2Cl:BTP-4F, PBDB-T-2Cl:PC61BM og PBDB-T-2Cl:BTP-4F:PC61BM; de kemiske strukturer af aktive lagkomponenter. Kredit:© Science China Press En tykfilm (3
- Hvad er størrelsen af et acetonemolekyle?
- Land under vand:Estimering af vandkrafts indvirkning på arealanvendelsen
- Undersøgelse afslører det atmosfæriske fodaftryk af en hiatus med global opvarmning
- Hvad er 27 meter på meter?
- Savannemiljøer tilhører den generelle klimatype kendt som?
- Stoktudser:Hvad de laver i skyggerne


