Hvad er Lewis -strukturen for Atom Mg Plus Br?
1. Bestem antallet af valenselektroner:
* Magnesium (Mg) har 2 valenselektroner.
* Brom (BR) har 7 valenselektroner.
2. Arranger atomerne:
* Magnesium (Mg) er i gruppe 2, så det danner typisk en +2 -kation (mg²⁺).
* Brom (BR) er i gruppe 17, så den danner typisk en -1 -anion (br⁻).
* For at afbalancere ladningerne har vi brug for to bromatomer (2BR⁻).
3. Tegn Lewis -strukturen:
* Magnesium mister sine to valenselektroner og danner en mg²⁺ion uden prikker omkring det.
* Hvert bromatom får en elektron og danner BR⁻ioner med 8 prikker omkring dem.
Her er Lewis -strukturen:
`` `
[Mg] ²⁺ [:Br:] ⁻ [:Br:] ⁻
`` `
Nøglepunkter:
* Beslagene angiver ionerne.
* Anklagerne vises uden for parenteserne.
* Hvert bromatom har en komplet oktet (8 elektroner).
* Magnesium har ingen valenselektroner tilbage.
Vigtig note: Denne Lewis -struktur repræsenterer den ioniske binding mellem magnesium og brom. Det er vigtigt at huske, at ioniske forbindelser ikke findes som enkeltmolekyler, men snarere som en gitterstruktur med skiftende ioner.
 Varme artikler
Varme artikler
-
 Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g
Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g -
 Naturlignende belægning gør batterier mere holdbare og effektiveCarbon nanorør belagt med en belægning ved anvendelse af kuldioxid i molekylær lagdeponering. Kredit:Aalto University Når batterier oplades og bruges, et komplekst SEI (fast elektrolytinterfase) l
Naturlignende belægning gør batterier mere holdbare og effektiveCarbon nanorør belagt med en belægning ved anvendelse af kuldioxid i molekylær lagdeponering. Kredit:Aalto University Når batterier oplades og bruges, et komplekst SEI (fast elektrolytinterfase) l -
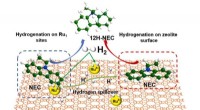 Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset
Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset -
 Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
- Typer af matematiske forhold mellem to variabler
- Hvad er fugtige vinde fra Mexicogolfen og arktisk?
- Hvordan konspirationsteorier opstår - og hvordan deres historier falder fra hinanden
- Forskere opdager den største tangblomst i verden
- Overførslen af elektroner fra et atom til et andet opnå et komplet yderste energiniveau kaldes?
- Forskeres wobulationsteknik tillader 3D-print af mere sofistikerede mikrostrukturer


