Hvad ville være den samlede masse af produkter, en reaktion, hvor 10 gram vand nedbrydes i elementer brint og ilt?
forståelse af reaktionen
Nedbrydningen af vand (H₂O) til brint (H₂) og ilt (O₂) er repræsenteret ved følgende afbalancerede kemiske ligning:
2H₂O → 2H₂ + O₂
Nøgleprincip:Loven om bevarelse af masse
Loven om bevarelse af masse hedder, at den samlede masse af reaktanterne før en kemisk reaktion skal svare til den samlede masse af produkterne efter reaktionen i et lukket system.
Beregning
1. molmasse vand (H₂O): 18 g/mol (2 g/mol til H + 16 g/mol til O)
2. mol vand: 10 g / 18 g / mol =0,556 mol H₂O
3. mol brint (H₂): Fra den afbalancerede ligning producerer 2 mol H₂O 2 mol H₂. Så 0,556 mol H₂O vil producere 0,556 mol H₂.
4. mol ilt (O₂): Fra den afbalancerede ligning producerer 2 mol H₂O 1 mol O₂. Så 0,556 mol H₂O vil producere 0,278 mol o₂.
5. Mass af brint (H₂): 0,556 mol H₂ * 2 g/mol =1,112 g H₂
6. masse ilt (O₂): 0,278 mol o₂ * 32 g/mol =8,90 g o₂
Total masse af produkter: 1.112 g H₂ + 8,90 g o₂ = 10.012 g
Konklusion
Den samlede masse af produkterne (brint og ilt) fra nedbrydningen af 10 gram vand er cirka 10 gram. Dette resultat er i overensstemmelse med loven om bevarelse af masse.
Sidste artikelHvordan får ilt?
Næste artikelIndeholder NaOH H plusioner?
 Varme artikler
Varme artikler
-
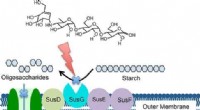 Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu,
Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu, -
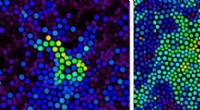 Dissektering af kolloidale briller ved hjælp af laser som lancetTypiske excitationsmønstre ved forskellige pakningsfraktioner. Gengivet fra fig. ~ 1b-d i naturen, 11. november 2020 (online). Kredit:IBS Bo Li og Kai Kou, Research Fellows fra IBS Center for Soft
Dissektering af kolloidale briller ved hjælp af laser som lancetTypiske excitationsmønstre ved forskellige pakningsfraktioner. Gengivet fra fig. ~ 1b-d i naturen, 11. november 2020 (online). Kredit:IBS Bo Li og Kai Kou, Research Fellows fra IBS Center for Soft -
 U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a
U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a -
 Ny krydsfænomenteori kunne forudsige effektiviteten af nye materialerVarme fra Solen resulterer i forskellige eksempler på krydsfænomener såsom fordampning af vand og fotosyntese til vækst af træer og afgrøder. Kredit:Elizabeth Flores-Gomez Murray. Alle rettigheder for
Ny krydsfænomenteori kunne forudsige effektiviteten af nye materialerVarme fra Solen resulterer i forskellige eksempler på krydsfænomener såsom fordampning af vand og fotosyntese til vækst af træer og afgrøder. Kredit:Elizabeth Flores-Gomez Murray. Alle rettigheder for
- Hvordan man undersøger, hvornår en robot forårsager en ulykke, og hvorfor det er vigtigt, at vi g…
- Hvordan fastholder vi lærere? At støtte dem til at arbejde sammen kunne hjælpe
- Husdyr- og fjerkræavl bør være det fremtidige fokus for landbrugets ammoniakemissionskontrol
- Hvad hedder den kemiske reaktion MN?
- Lille biologisk pakke får lægemidlet lige til hjertet af transplantationsafstødning
- En orkidé, der aldrig blomstrer


