Hvad er forholdet mellem atomnumre og ioniske radier af elementer i gruppe 3A?
Generel tendens:
* ionisk radier stigning, når du bevæger dig ned i gruppe 3a.
Forklaring:
* atomnummer og elektronskaller: Atomnummer øges, når du går ned i gruppen. Dette betyder, at antallet af elektronskaller øges. Hver ekstra skal tilføjer atomets størrelse.
* afskærmningseffekt: Når du bevæger dig ned ad gruppen, øges antallet af indre elektroner (kerneelektroner). Disse kerneelektroner beskytter de ydre valenselektroner mod attraktionen af kernen. Denne afskærmningseffekt reducerer den effektive atomafgift, der føles af valenselektronerne, hvilket giver dem mulighed for at optage et større rum.
* ionisk dannelse: Gruppe 3A -elementer har en tendens til at danne +3 ioner ved at miste deres tre valenselektroner. Tabet af disse elektroner fører til et fald i den elektronelektroniske frastødning, hvilket gør ionen mindre end det neutrale atom. Imidlertid dominerer stigningen i størrelse på grund af de yderligere elektronskaller, der stadig er, hvilket resulterer i en samlet stigning i ioniske radier, når du bevæger dig ned i gruppen.
Eksempel:
* Boron (B) har den mindste ioniske radius, efterfulgt af aluminium (AL), gallium (GA), indium (IN) og thallium (TL).
Vigtig note: Der er nogle små variationer i tendensen på grund af faktorer som D-Block-sammentrækning og lanthanidkontraktion. Imidlertid forbliver den samlede tendens med stigende ioniske radier med stigende atomnummer i gruppe 3A gyldigt.
Sidste artikelNedkommer magnesiumcarbonat ved Bunsen -brænderen?
Næste artikelHvad er carbon i isotope som reference til atommasseenhed?
 Varme artikler
Varme artikler
-
 Kemikere syntetiserer ultrahurtig cyaniddetektorKredit:CC0 Public Domain Organiske kemikere ved Kaunas University of Technology (KTU), Litauen har syntetiseret et nyt materiale, som kan bruges som en detektor for cyanider i vand. Ved kontakt me
Kemikere syntetiserer ultrahurtig cyaniddetektorKredit:CC0 Public Domain Organiske kemikere ved Kaunas University of Technology (KTU), Litauen har syntetiseret et nyt materiale, som kan bruges som en detektor for cyanider i vand. Ved kontakt me -
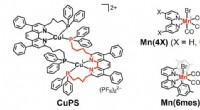 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
 Meget effektiv hydrogengasproduktion ved hjælp af sollys, vand og hæmatitMesokrystal fotoanoddannelse og fotokemiske vandopdelingskarakteristika. en. Elektronmikroskopbillede af en hæmatit mesokrystal (samlet fra små nano-partikler på ca. 5 nm). b. Gasproduktion fra anoden
Meget effektiv hydrogengasproduktion ved hjælp af sollys, vand og hæmatitMesokrystal fotoanoddannelse og fotokemiske vandopdelingskarakteristika. en. Elektronmikroskopbillede af en hæmatit mesokrystal (samlet fra små nano-partikler på ca. 5 nm). b. Gasproduktion fra anoden -
 Ny eksfolieringsteknik genvinder biomaterialers piezoelektricitetZhang Zhuomin, et medlem af Dr. Yang Zhengbaos forskerhold, demonstrerer råmaterialet i tyndtarmens submucosa fra får. Kredit:City University of Hong Kong Piezoelektriske materialer er anvendelige
Ny eksfolieringsteknik genvinder biomaterialers piezoelektricitetZhang Zhuomin, et medlem af Dr. Yang Zhengbaos forskerhold, demonstrerer råmaterialet i tyndtarmens submucosa fra får. Kredit:City University of Hong Kong Piezoelektriske materialer er anvendelige
- Et nærbillede af Mars? Ikke sandsynligt, siger Penn State Erie-professor
- Storbritannien varmere og vådere på grund af klimaændringer:undersøgelse
- Hvilken placering er 31,68 N breddegrad?
- Fysikere får forståelse for, hvordan bobler ved kantplasmaerne kan dræne varme og reducere effekt…
- Forskere udvikler løsning til fremstilling af makroskopiske 2-D MXener
- Ser man på stjernerne, eller falder i vejen? Hvordan astronomi svigter kvindelige videnskabsmænd


