Når 15 g NaCLO3 og 20 Cr2O3 reagerer, hvilket vil begrænse reaktionen?
1. Skriv den afbalancerede kemiske ligning
Først har vi brug for den afbalancerede kemiske ligning for reaktionen mellem NaCLO3 (natriumchlorat) og CR2O3 (chrom (III) oxid). Denne reaktion er lidt kompleks og producerer flere produkter. Det er sandsynligt, at du er interesseret i dannelsen af natriumchromat (Na2Cro4). Den afbalancerede ligning ville være:
6 NaCLO3 + 2 CR2O3 → 2 Na2cro4 + 6 NaCl + 3 O2
2. Konverter masser til mol
* naclo3:
* Molmasse af NaCLO3 =106,44 g/mol
* Mol NaCLO3 =(15 g) / (106,44 g / mol) =0,141 mol
* CR2O3:
* Molmasse CR2O3 =151,99 g/mol
* Mol Cr2O3 =(20 g) / (151,99 g / mol) =0,132 mol
3. Bestem molforholdet fra den afbalancerede ligning
Den afbalancerede ligning viser, at 6 mol NaCLO3 reagerer med 2 mol CR2O3.
4. Beregn den begrænsende reaktant
* naclo3: Hvis alle 0,141 mol NaCLO3 reagerede, ville det kræve (0,141 mol NaCLO3) * (2 mol CR2O3 / 6 mol NaCLO3) =0,047 mol CR2O3. Vi har mere end nok CR2O3 (0,132 mol).
* CR2O3: Hvis alle 0,132 mol CR2O3 reagerede, ville det kræve (0,132 mol CR2O3) * (6 mol NaCLO3 / 2 mol CR2O3) =0,396 mol NaCLO3. Vi har ikke nok NaCLO3 (kun 0,141 mol).
Konklusion:
Da vi ikke har nok NaCLO3 til at reagere med alle CR2O3, er NaCLO3 den begrænsende reaktant .
Sidste artikelHvad er en løsning, og hvad er de 2 grundlæggende dele af løsningen?
Næste artikelHvilke metaller opvarmes?
 Varme artikler
Varme artikler
-
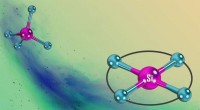 Silicium med en todimensionel strukturÆndringer i siliciums naturlige tetraedriske struktur (øverst til venstre) i en usædvanlig kvadratisk plan geometri (nederst til højre). Kredit:Ebner/Greb (Heidelberg) Silicium, et halvmetal, bind
Silicium med en todimensionel strukturÆndringer i siliciums naturlige tetraedriske struktur (øverst til venstre) i en usædvanlig kvadratisk plan geometri (nederst til højre). Kredit:Ebner/Greb (Heidelberg) Silicium, et halvmetal, bind -
 Detaljeret fotodissociationsdynamik af hydrogensulfid afsløretRotations- og nuklear-spin-niveauafhængig multi-kanal produktmåling og fotodissociationsmekanismer af H 2 S. Kredit:ZHAO Yarui og YUAN Kaijun Svovlbrinte (H 2 S) er et af de vigtigste molekyle
Detaljeret fotodissociationsdynamik af hydrogensulfid afsløretRotations- og nuklear-spin-niveauafhængig multi-kanal produktmåling og fotodissociationsmekanismer af H 2 S. Kredit:ZHAO Yarui og YUAN Kaijun Svovlbrinte (H 2 S) er et af de vigtigste molekyle -
 Ny lim kan gøre millioner af medicinske procedurer sikrere, mindre invasiv for patienterPurdue University lektor Julie Liu, til venstre, og doktorand Sydney Hollingshead hjalp med at skabe en lim, der kunne gøre medicinske procedurer sikrere. Kredit:Purdue University billede/Erin Easterl
Ny lim kan gøre millioner af medicinske procedurer sikrere, mindre invasiv for patienterPurdue University lektor Julie Liu, til venstre, og doktorand Sydney Hollingshead hjalp med at skabe en lim, der kunne gøre medicinske procedurer sikrere. Kredit:Purdue University billede/Erin Easterl -
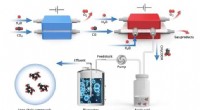 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
- Garn skabt af hudceller kan væves ind i menneskelige tekstiler
- Modellering af Jordens kemi:Gør det usynlige synligt
- NASA kaster et infrarødt øje på den tropiske storm Kujiras meget kolde skytoppe
- Generering af elektrisk strøm fra spildvarme
- Hvorfor Olie vil ikke blande i vand?
- Molekylære interaktioner er nøglen til, hvordan nanopartikler opfører sig i celler


