Hvad er pH for en opløsning, der indeholder 0,535 G NHCl i 50 ml 0,1 M NH?
1. Forstå kemi
* nh₃ (ammoniak): En svag base.
* nh₄cl (ammoniumchlorid): Salt af en svag base (NH₃) og en stærk syre (HCI). Dette salt hydrolyserer i vand, producerer H⁺ioner og gør opløsningen sur.
2. Opret ligevægten
Den relevante ligevægt er hydrolysen af ammoniumionen (NH₄⁺):
NH₄⁺ (aq) + H₂O (L) ⇌ NH₃ (aq) + H₃O⁺ (aq)
3. Beregn de indledende koncentrationer
* [nh₄⁺]:
- Molmasse af NH₄CL =53,49 g/mol
- mol NH₄CL =0,535 g / 53,49 g / mol =0,01 mol
- [NH₄⁺] =0,01 mol / 0,05 L =0,2 m
* [nh₃]:
- [NH₃] =0,1 m (givet)
4. Brug isbordet
| | NH₄⁺ | H₂O | NH₃ | H₃O⁺ |
| ------------- | ---------- | ---------- | ---------- | ---------- |
| Indledende (i) | 0,2 m | | 0,1 m | 0 |
| Ændring (c) | -x | | +x | +x |
| Ligevægt (E) | 0,2-x | | 0,1+x | X |
5. Skriv ligevægtsudtrykket
Kₐ for NH₄⁺ er 5,6 x 10⁻¹⁰ (du kan finde denne værdi i en tabel med syre dissociationskonstanter)
Kₐ =[nh₃] [h₃o⁺] / [nh₄⁺] =(0,1+x) (x) / (0,2-x)
6. Lav tilnærmelser
Da Kₐ er meget lille, kan vi antage, at X er ubetydelig sammenlignet med 0,1 og 0,2. Dette forenkler ligningen:
5,6 x 10⁻¹⁰ ≈ (0,1) (x) / 0,2
7. Løs for x
x =[h₃o⁺] ≈ 1,12 x 10⁻⁹ m
8. Beregn pH
ph =-log [h₃o⁺] =-log (1,12 x 10⁻⁹) ≈ 8,95
Derfor er pH -værdien ca. 8,95.
Sidste artikelHvad er anklagerne for hver del af et atom?
Næste artikelHvordan dannes kemiske klipper?
 Varme artikler
Varme artikler
-
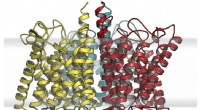 Biokemikere viser, hvordan evolutionen kombinerer en næringsstofsensor fra eksisterende grundstoffe…Hypotetisk udvidet model af anammox ammoniumsensorproteinet. Kredit:Susana Andrade Et hold ledet af Freiburg biokemikeren prof. Dr. Susana Andrade har karakteriseret et protein, der gør det muligt
Biokemikere viser, hvordan evolutionen kombinerer en næringsstofsensor fra eksisterende grundstoffe…Hypotetisk udvidet model af anammox ammoniumsensorproteinet. Kredit:Susana Andrade Et hold ledet af Freiburg biokemikeren prof. Dr. Susana Andrade har karakteriseret et protein, der gør det muligt -
 Video:Hvordan gaskomfurer forurener dit hjemKredit:The American Chemical Society Mange af os elsker vores gaskomfurer. Men desværre kan de skabe indendørs forureningsniveauer, der overstiger lovlige udendørs forureningsniveauer. Denne video
Video:Hvordan gaskomfurer forurener dit hjemKredit:The American Chemical Society Mange af os elsker vores gaskomfurer. Men desværre kan de skabe indendørs forureningsniveauer, der overstiger lovlige udendørs forureningsniveauer. Denne video -
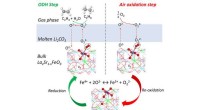 Katalysator åbner døren til mere effektiv, miljøvenlig produktion af ethylenReaktionsveje til oxidativ dehydrogenering af ethan lettet af den smeltede carbonatskal modificerede perovskit redox katalysator. Kredit:Fanxing Li, NC State University Et forskerhold ledet af Nor
Katalysator åbner døren til mere effektiv, miljøvenlig produktion af ethylenReaktionsveje til oxidativ dehydrogenering af ethan lettet af den smeltede carbonatskal modificerede perovskit redox katalysator. Kredit:Fanxing Li, NC State University Et forskerhold ledet af Nor -
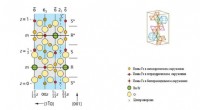 Forskere udvikler materialer til kvanteberegningKrystalstruktur af M-type hexagonal ferrit (en type magnetoplumbit). Kredit:South Ural State University (SUSU) Oprettelse af innovative materialer er et af de vigtigste områder af moderne videnska
Forskere udvikler materialer til kvanteberegningKrystalstruktur af M-type hexagonal ferrit (en type magnetoplumbit). Kredit:South Ural State University (SUSU) Oprettelse af innovative materialer er et af de vigtigste områder af moderne videnska
- Hvad er en afbalanceret ligning for KNO3 NABR og CAS?
- Ardern-ture, der ødelægger oversvømmelser i New Zealand
- Luftforureningens eksponering ulighed vedvarer i Massachusetts
- At tale med os selv:Hvordan forbrugere navigerer i valg og indre konflikter
- Amerikansk dommer lader Musk ændre Twitter-krav, afviser udsættelse af sagen
- Orkanen Isaias brøler i land på den amerikanske østkyst


