Hvordan dannes kemiske klipper?
1. Vand som opløsningsmiddel:
- Vand er et fremragende opløsningsmiddel, der opløser forskellige mineraler fra klipper og jord, når det flyder. Dette skaber en opløsning, der indeholder opløste mineraler.
2. Fordampning og koncentration:
- Da vandlegemet (sø, hav, lagune) fordamper, øges koncentrationen af opløste mineraler i det resterende vand.
- Dette er som at fremstille en koncentreret saltopløsning ved at koge vand fra en saltvandsblanding.
3. Udfældning:
- Når koncentrationen af opløste mineraler når et mætningspunkt, begynder mineralerne at udfælde ud af opløsningen og krystalliseres.
- Denne proces ligner, hvordan sukkerkrystaller dannes, når du koger en sukkerholdig sirup, indtil den er supermættet.
4. Dannelse af kemiske klipper:
- De udfældede mineralkrystaller akkumuleres, binder sammen og danner til sidst faste klippelag.
- Disse klipper kaldes kemiske klipper eller fordampninger, fordi de blev dannet ved kemisk nedbør fra en vandopløsning.
Eksempler på kemiske klipper:
* halit (rock salt): Dannet ved fordampning af havvand og nedbør af natriumchlorid.
* gips: Dannet ved fordampning af havvand eller andre vandmasser med høje koncentrationer af calciumsulfat.
* rock gips (anhydrit): Dannet af gips, når det mister vandmolekyler på grund af varme eller tryk.
* dolomite: Dannet ved udskiftning af calcium i kalksten med magnesium.
Nøglefaktorer, der påvirker dannelsen:
* Klima: Varmt og tørt klima med høje fordampningshastigheder favoriserer dannelsen af kemiske klipper.
* Vandkilde: Havvand, søer og laguner kan alle bidrage til dannelsen af evaporitter.
* Kemi af vandet: Typerne og koncentrationerne af opløste mineraler bestemmer de specifikke typer af evaporitter, der dannes.
Interessant kendsgerning: Kemiske klipper er vigtige kilder til mineraler og ressourcer som salt, gips og potash, der bruges i forskellige brancher.
 Varme artikler
Varme artikler
-
 Hydrogenbrændstoffer raketter, men hvad med strøm til dagligdagen? Var ved at komme tættere påNASA har lanceret alle sine rumfærgemissioner med brint som brændstof. Kredit:NASA, CC BY Brint er det første grundstof i det periodiske system. I sin rene form er hydrogen et lys, farveløs gas, m
Hydrogenbrændstoffer raketter, men hvad med strøm til dagligdagen? Var ved at komme tættere påNASA har lanceret alle sine rumfærgemissioner med brint som brændstof. Kredit:NASA, CC BY Brint er det første grundstof i det periodiske system. I sin rene form er hydrogen et lys, farveløs gas, m -
 Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E
Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E -
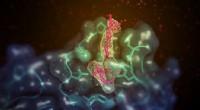 Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S -
 Skab en bedre paryk med kemiHår belagt med en nanokomposit (til venstre) ved hjælp af Langmuir-Blodgett-teknikken genererer meget mindre statisk elektricitet end ubehandlede hår (højre). Kredit:Tilpasset fra ACS Applied Material
Skab en bedre paryk med kemiHår belagt med en nanokomposit (til venstre) ved hjælp af Langmuir-Blodgett-teknikken genererer meget mindre statisk elektricitet end ubehandlede hår (højre). Kredit:Tilpasset fra ACS Applied Material
- Verdens største undersøgelse viser, at CO2-priser reducerer emissionerne
- På hvilket lag bor vi?
- Californien skrider til handling for at reducere mere plastikaffald, herunder dagligvareposer
- Sådan beregnes Force of Impact
- Hvilken form for reaktion er fotosyntese?
- Super grafen kan hjælpe med at behandle kræft


