Hvad er produkterne, når vand nedbrydes ved elektrolyse?
Her er en sammenbrud af processen:
* elektrolyse: Dette er processen med at bruge en elektrisk strøm til at drive en ikke-spontan kemisk reaktion.
* vandmolekyler (H₂O): Hvert vandmolekyle indeholder to hydrogenatomer og et iltatom.
* Elektroder: Elektrolyse bruger to elektroder (positiv anode og negativ katode) nedsænket i vandet.
* reaktion: Den elektriske strøm får vandmolekylerne til at opdele:
* Ved katoden (negativ elektrode) får brintioner (H+) elektroner og danner brintgas (H₂).
* Ved anoden (positiv elektrode) mister iltioner (O²-) elektroner og danner iltgas (O₂).
Den samlede kemiske ligning til elektrolyse af vand er:
2H₂O → 2H₂ + O₂
Dette betyder, at for hver to vandmolekyler nedbrudt, produceres to molekyler med brintgas og et molekyle af iltgas.
 Varme artikler
Varme artikler
-
 Hvordan ændrer denne blå blomst te farve?Kredit:The American Chemical Society Måske har du set en smuk, farveskiftende te på sociale medier. Chancerne er, det er sommerfugleærteblomstte. Denne uge, vi undersøger, hvad der gør det muligt
Hvordan ændrer denne blå blomst te farve?Kredit:The American Chemical Society Måske har du set en smuk, farveskiftende te på sociale medier. Chancerne er, det er sommerfugleærteblomstte. Denne uge, vi undersøger, hvad der gør det muligt -
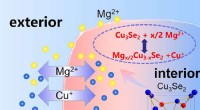 Kobberion låser op for magnesium potentiale i næste generations batterierVed at tilføje en kobberion, nyt magnesiumbatteri demonstrerer dramatisk forbedring af ydeevnen. Kredit:CUI Guanglei Forskere ved Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT)
Kobberion låser op for magnesium potentiale i næste generations batterierVed at tilføje en kobberion, nyt magnesiumbatteri demonstrerer dramatisk forbedring af ydeevnen. Kredit:CUI Guanglei Forskere ved Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) -
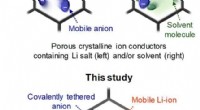 Undersøgelse:Ny opløsningsmiddelfri, enkelt lithium-ion-ledende kovalent organisk skeletVist ovenfor er de konceptuelle illustrationer af iontransportfænomener i de porøse krystallinske ionledere:tidligere tilgange (øverst) og denne undersøgelse (nederst). Kredit:UNIST En nylig under
Undersøgelse:Ny opløsningsmiddelfri, enkelt lithium-ion-ledende kovalent organisk skeletVist ovenfor er de konceptuelle illustrationer af iontransportfænomener i de porøse krystallinske ionledere:tidligere tilgange (øverst) og denne undersøgelse (nederst). Kredit:UNIST En nylig under -
 Instant messaging i proteiner opdagetLisa-Marie Funk, medførsteforfatter, analysere proteinkrystaller ved hjælp af et mikroskop forud for besøget i DESY Hamburg. Kredit:Nora Eulig Proteiner er essentielle for enhver levende celle og
Instant messaging i proteiner opdagetLisa-Marie Funk, medførsteforfatter, analysere proteinkrystaller ved hjælp af et mikroskop forud for besøget i DESY Hamburg. Kredit:Nora Eulig Proteiner er essentielle for enhver levende celle og
- Marangoni-strømme driver justeringen af fibrillære celleladede hydrogeler
- Ny SIMPLEx-mission, lille satellit til at skyde spor, der studerer månens overflade
- Hydrogel fremmer sårheling bedre end traditionelle bandager, gazebind
- Dækafgrøder kan bruges til at afbøde og tilpasse sig klimaændringer
- Materie under ekstreme forhold med meget høje temperaturer og tryk viser sig at være bemærkelsesv…
- Brug kunstig intelligens til at forstå kollektiv adfærd


