Hvilket volumen O2 opsamlet ved 22,0 ° C og 728 mm Hg ville blive produceret ved nedbrydning 8,15 g KCLO3?
1. Skriv den afbalancerede kemiske ligning:
2 KCLO₃ (S) → 2 KCl (S) + 3 O₂ (G)
2. Beregn molen af KCLO₃:
* Molmasse KCLO₃ =39,10 g/mol + 35,45 g/mol + 3 * 16,00 g/mol =122,55 g/mol
* Mol KCLO₃ =(8,15 g) / (122,55 g / mol) =0,0665 mol
3. Beregn molen af O₂ produceret:
* Fra den afbalancerede ligning producerer 2 mol KCLO₃ 3 mol O₂.
* Mol O₂ =(0,0665 mol KCLO₃) * (3 mol O₂ / 2 mol KCLO₃) =0,0998 mol O₂
4. Konverter temperaturen til Kelvin:
* T (k) =t (° C) + 273.15
* T (k) =22,0 ° C + 273,15 =295,15 K
5. Konverter presset til atmosfærer:
* 1 atm =760 mm Hg
* P (atm) =(728 mm Hg) / (760 mm Hg / atm) =0,958 atm
6. Brug den ideelle gaslov til at beregne volumen:
* PV =NRT
* V =(NRT) / P
* Hvor:
* V =volumen (l)
* n =mol (mol)
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
* P =pres (ATM)
* V =(0,0998 mol * 0,0821 L · ATM / mol · K * 295,15 K) / 0,958 atm
* V = 2,54 L
Derfor ville 2,54 L O₂ blive produceret ved 22,0 ° C og 728 mm Hg.
Sidste artikelHvordan producerer luftmolekyler tryk?
Næste artikelHvilke ioner har ikke 18 elektroner?
 Varme artikler
Varme artikler
-
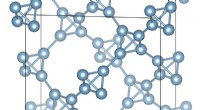 Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult
Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult -
 Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind
Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind -
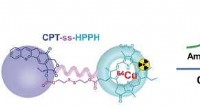 Nanopartikler med multifunktionel lægemiddelprecursor til synergistisk tumorterapiKredit:Wiley Til effektiv kræftbehandling med få bivirkninger, det aktive lægemiddel bør selektivt opnå høj koncentration i tumoren. I journalen Angewandte Chemie , videnskabsmænd har introducer
Nanopartikler med multifunktionel lægemiddelprecursor til synergistisk tumorterapiKredit:Wiley Til effektiv kræftbehandling med få bivirkninger, det aktive lægemiddel bør selektivt opnå høj koncentration i tumoren. I journalen Angewandte Chemie , videnskabsmænd har introducer -
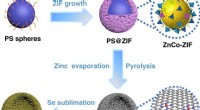 Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite
Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite


