Hvilke ioner har ikke 18 elektroner?
Forståelse af elektronkonfigurationer
* stabil octet: Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil elektronkonfiguration som en ædelgas. Dette betyder ofte at have 8 elektroner i deres ydre skal (oktetreglen).
* ædle gasser: Ædle gasser har en fuld ydre skal af elektroner, hvilket gør dem meget stabile.
Find ioner med 18 elektroner
* argon (AR): Argon er en ædel gas med 18 elektroner.
* ioner med 18 elektroner: Atomer, der får eller mister elektroner for at nå en elektronkonfiguration som argon, har 18 elektroner. Eksempler:
* k+ (kaliumion): Kalium mister en elektron for at opnå en argonkonfiguration.
* cl- (chloridion): Klor får en elektron for at opnå en argonkonfiguration.
* Ca2+ (calciumion): Calcium mister to elektroner for at opnå en argonkonfiguration.
ioner med 10 eller 36 elektroner
* neon (NE): Neon er en ædel gas med 10 elektroner.
* krypton (KR): Krypton er en ædel gas med 36 elektroner.
Eksempler på ioner, der ikke har 18 elektroner
* Na+ (natriumion): Natrium mister en elektron og efterlader den med 10 elektroner (som neon).
* o2- (oxidion): Oxygen får to elektroner, hvilket giver det 10 elektroner (som neon).
* s2- (sulfidion): Svovl får to elektroner, hvilket giver det 18 elektroner.
* Br- (bromidion): Brom vinder en elektron, hvilket giver det 36 elektroner (som Krypton).
Kortfattet
For at bestemme, om en ion har 18 elektroner, skal du overveje antallet af elektroner, som atomet har brug for for at vinde eller tabe for at opnå elektronkonfigurationen af argon. Hvis det har brug for flere eller færre elektroner end det, har ion ikke 18 elektroner.
 Varme artikler
Varme artikler
-
 Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de
Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de -
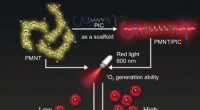 Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi
Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi -
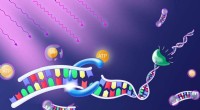 Programmering med lyskontaktenUdsættelse for lys frigiver molekylet ATP. Det giver energien til et enzym (blåt), der forbinder DNA-byggesten til en streng. Et andet enzym (grønt) adskiller strengen ved disse bindingssteder, sålede
Programmering med lyskontaktenUdsættelse for lys frigiver molekylet ATP. Det giver energien til et enzym (blåt), der forbinder DNA-byggesten til en streng. Et andet enzym (grønt) adskiller strengen ved disse bindingssteder, sålede -
 Banebrydende kemi tilgang kunne føre til mere robust blød elektronikEn ny tilgang til at studere konjugerede polymerer gjorde det muligt for et hærfinansieret forskerhold at måle, for første gang, de enkelte molekylers mekaniske og kinetiske egenskaber under polymeris
Banebrydende kemi tilgang kunne føre til mere robust blød elektronikEn ny tilgang til at studere konjugerede polymerer gjorde det muligt for et hærfinansieret forskerhold at måle, for første gang, de enkelte molekylers mekaniske og kinetiske egenskaber under polymeris
- Hvordan er den mekaniske metode til bekæmpelse af ukrudt forskellig fra den biologiske metode?
- Effektiv, miljøvenlig produktion af finkemikalier
- Hvad repræsenterer atomnummeret for en elemnet?
- Hvad viser balancerede kemiske ligninger?
- Hvordan påvirker væskedensiteten bevægelse af et objekt?
- Super-Jordens exoplanet i kredsløb om nærliggende stjerne opdaget


