Hvorfor geometri af H2O ikke er lineær, hvorimod CO2 lineær?
vand (H₂O):
* Hybridisering: Oxygenatomet i vand gennemgår SP³ -hybridisering. Dette betyder, at dens fire elektronpar (to bindingspar og to ensomme par) er arrangeret i en tetrahedral geometri.
* Lone Pair Repulsion: De to ensomme par på iltatomet udøver en stærkere frastødende kraft end bindingsparene. Dette skubber de to hydrogenatomer tættere sammen, hvilket resulterer i en bøjet eller V-formet molekylær geometri.
* Bond vinkel: H-O-H-bindingsvinklen i vandet er ca. 104,5 °, hvilket afviger markant fra 180 ° vinkel på et lineært molekyle.
kuldioxid (CO₂):
* Hybridisering: Carbonatomet i kuldioxid gennemgår SP -hybridisering. Dette betyder, at dets to elektronpar (begge bindingspar) er arrangeret lineært.
* Ingen ensomme par: Carbon har ingen ensomme par, så der er ingen frastødelse til at fordreje det lineære arrangement.
* Bond vinkel: O-C-O-bindingsvinklen i kuldioxid er 180 °, hvilket resulterer i et perfekt lineært molekyle.
Kortfattet:
Forskellen i geometri opstår fra tilstedeværelsen af ensomme par på iltatomet i vand. Disse ensomme par skaber en stærkere frastødning end bindingsparene, hvilket tvinger molekylet til en bøjet form. Kuldioxid, uden ensomme par på det centrale carbonatom, opretholder en lineær struktur.
Sidste artikelHvilken juice vil fordampe hurtigst med salt?
Næste artikelHvornår er vand et opløst stof?
 Varme artikler
Varme artikler
-
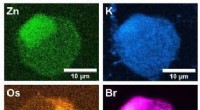 Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185
Forskere observerer, hvordan potentiel kræftbehandling reagerer i en enkelt celleRøntgenfluorescensbilleder taget ved I14-strålelinjen ved Diamond Light Source:Det grønne er zink, blå er kalium, orange er osmium og pink er brom. Kredit:University of Warwick Ved hjælp af en 185 -
 Fremtidige hærkøretøjer kunne se en forbedring af strukturelle materialerHærens forskere ser på nye konstruktionsmaterialer til ubemandede køretøjssystemer, såsom RQ-7B Shadow vist her, fordi disse materialer er mindre modtagelige for korrosion, lette og har højere elektri
Fremtidige hærkøretøjer kunne se en forbedring af strukturelle materialerHærens forskere ser på nye konstruktionsmaterialer til ubemandede køretøjssystemer, såsom RQ-7B Shadow vist her, fordi disse materialer er mindre modtagelige for korrosion, lette og har højere elektri -
 Nyt hardcarbonanodemateriale til natriumionbatterier løser litiumproblemetDen nye kapacitet af dette nye hårde kulstofelektrodemateriale betyder, at en 19% stigning i energitæthed i vægt er mulig i natriumionbatterier sammenlignet med lithium-ion-batterier Kredit:Shinichi K
Nyt hardcarbonanodemateriale til natriumionbatterier løser litiumproblemetDen nye kapacitet af dette nye hårde kulstofelektrodemateriale betyder, at en 19% stigning i energitæthed i vægt er mulig i natriumionbatterier sammenlignet med lithium-ion-batterier Kredit:Shinichi K -
 Nye nanoporøse metalskum bruger sollys til at rense vandKredit:University of Bath En forsker fra University of Bath går forrest i at skabe et nyt, mere effektiv måde for vandindustrien til sikkert at fjerne mikropollutanter fra vand uden at øge deres C
Nye nanoporøse metalskum bruger sollys til at rense vandKredit:University of Bath En forsker fra University of Bath går forrest i at skabe et nyt, mere effektiv måde for vandindustrien til sikkert at fjerne mikropollutanter fra vand uden at øge deres C
- Hvordan træner du halvdelen af koncentrationer?
- 7 Hovedstadier af en stjerne
- Hvilken struktur i en dyrecelle har det største volumen?
- Metan, der udsendes af mennesker, er enormt undervurderet, finder forskere
- Hvad er den ejendom, hvorpå friskskåret overflade af et metal skinner?
- Begynder en ny solcyklus?


